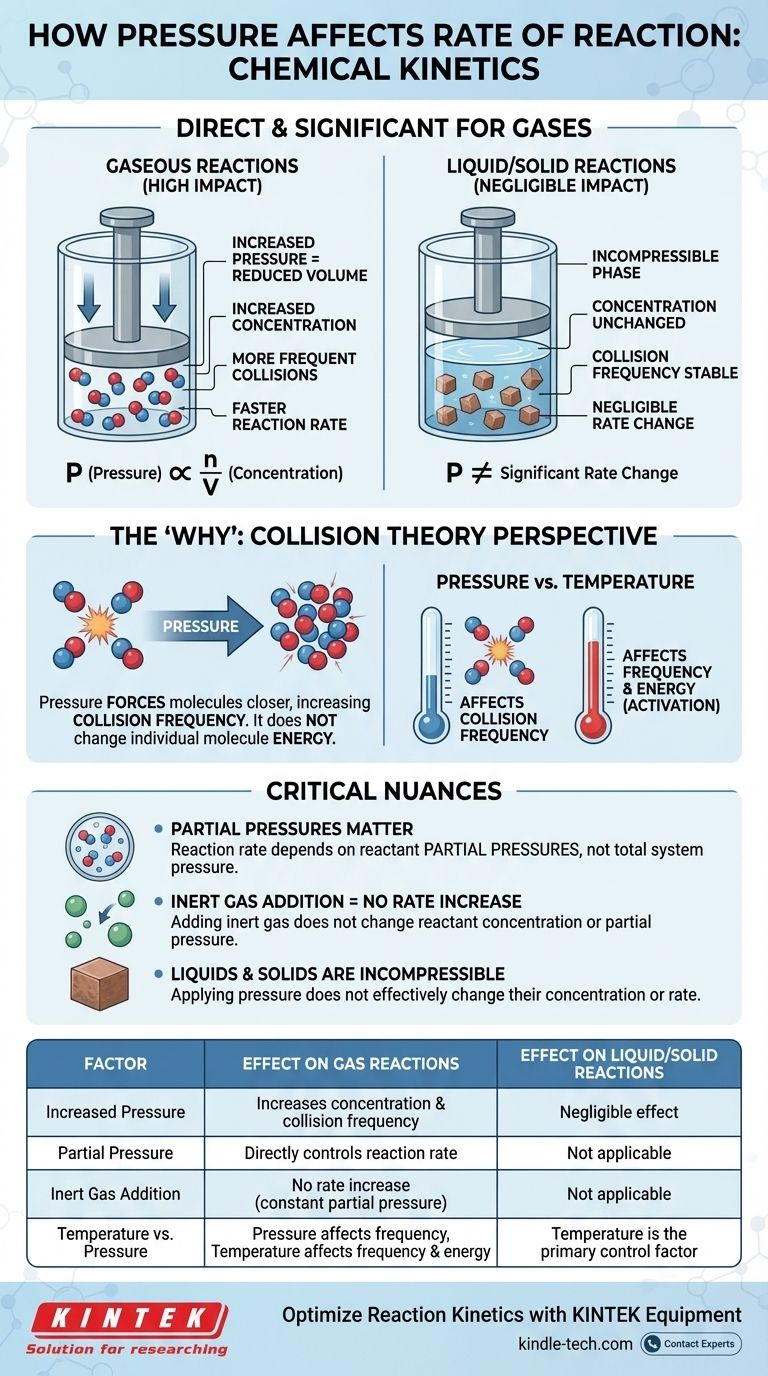
En cinética química, el efecto de la presión sobre la velocidad de reacción es directo y significativo, pero solo para reacciones que involucran gases. Para una reacción gaseosa, aumentar la presión incrementa la concentración de las moléculas de los reactivos. Esto conduce a colisiones más frecuentes entre ellas, lo que a su vez aumenta la velocidad general de la reacción. Para reacciones que ocurren puramente en fases líquidas o sólidas, la presión tiene un efecto insignificante sobre la velocidad.
La relación entre presión y velocidad de reacción es fundamentalmente una historia sobre la concentración. Para los gases, el aumento de la presión es simplemente un medio físico para forzar más moléculas en el mismo volumen, aumentando la frecuencia de colisiones efectivas y, por lo tanto, acelerando la reacción.

El vínculo fundamental: la presión como sustituto de la concentración
La razón principal por la que la presión afecta a las reacciones gaseosas radica en su relación directa con la concentración. Este principio se explica mejor examinando las leyes fundamentales de la química.
El papel de la Ley de los Gases Ideales
La Ley de los Gases Ideales, PV = nRT, proporciona el vínculo matemático. Si la reordenamos para despejar la presión (P = (n/V)RT), podemos ver que la presión (P) es directamente proporcional a n/V.
El término n/V representa moles (n) por unidad de volumen (V), que es la definición misma de concentración molar. Por lo tanto, a medida que aumenta la presión de un sistema a temperatura constante, se está aumentando directamente la concentración de las moléculas de gas dentro de él.
Cómo la concentración rige la velocidad de reacción
La velocidad de una reacción se define por su ley de velocidad, a menudo expresada como velocidad = k[A]^m[B]^n. En esta ecuación, [A] y [B] representan las concentraciones de los reactivos.
La ley de velocidad muestra que la velocidad de reacción depende directamente de la concentración de sus reactivos. Una mayor concentración significa una velocidad más rápida. Al conectar esto con la ley de los gases, la cadena de eventos se vuelve clara: el aumento de la presión aumenta la concentración, lo que a su vez aumenta la velocidad de reacción.
El "porqué" del cambio: una perspectiva de la teoría de colisiones
Las leyes de velocidad nos dicen qué sucede, pero la Teoría de Colisiones explica por qué sucede a nivel molecular. Para que ocurra una reacción, las partículas de los reactivos deben chocar con suficiente energía y la orientación correcta.
El principio de la frecuencia de colisión
Una reacción química es el resultado de innumerables colisiones moleculares. Cuantas más colisiones ocurran por segundo, más oportunidades habrá para que ocurra una reacción exitosa.
Cómo la presión impulsa las colisiones
Aumentar la presión sobre un gas reduce el volumen que ocupa, forzando a las moléculas a acercarse. Esto aumenta drásticamente su frecuencia de colisión, el número de veces que chocan entre sí por unidad de tiempo.
Si bien la presión no cambia la energía de las moléculas individuales (ese es el papel de la temperatura), multiplica el número total de eventos de colisión. Este aumento en la frecuencia conduce a un aumento proporcional en las colisiones exitosas que causan reacciones.
Comprendiendo los matices y las compensaciones
Si bien la regla general se mantiene, un experto debe comprender las condiciones específicas bajo las cuales se aplica y, lo que es más importante, cuándo no.
El papel crítico de las presiones parciales
En una mezcla de gases, la velocidad de reacción general depende de las presiones parciales de los reactivos específicos, no de la presión total del sistema. La presión parcial es la presión que un solo gas ejercería si ocupara solo todo el volumen.
Esto significa que se puede aumentar la presión total añadiendo un gas inerte (como argón o nitrógeno) al recipiente de reacción. Sin embargo, dado que esto no cambia la concentración o la presión parcial de los reactivos reales, no aumentará la velocidad de reacción.
El efecto insignificante sobre líquidos y sólidos
La presión tiene un impacto insignificante en las velocidades de reacción en fases condensadas (líquidos y sólidos). Estos estados de la materia ya se consideran incompresibles.
Las moléculas en líquidos y sólidos ya están muy juntas. La aplicación de presión externa no disminuye significativamente la distancia entre ellas ni cambia su concentración. Por lo tanto, no es una palanca eficaz para cambiar sus velocidades de reacción.
Presión vs. Temperatura
Es crucial distinguir los efectos de la presión y la temperatura.
- La presión afecta principalmente la frecuencia de las colisiones.
- La temperatura afecta tanto la frecuencia de las colisiones (las moléculas se mueven más rápido) como, lo que es más importante, la energía de cada colisión.
Elevar la temperatura aumenta la fracción de moléculas que poseen la energía de activación mínima requerida, lo que la convierte en un factor mucho más potente para aumentar las velocidades de reacción que la presión.
Tomando la decisión correcta para su sistema
Comprender este principio le permite controlar los resultados de la reacción en función de sus objetivos específicos. Considere lo siguiente al diseñar u optimizar un proceso químico.
- Si su objetivo principal es maximizar la velocidad de una reacción gaseosa: Aumentar la presión del sistema reduciendo su volumen es un método directo y eficaz para aumentar el rendimiento.
- Si su objetivo principal es controlar una reacción en una mezcla de gases: Debe gestionar las presiones parciales de los reactivos, ya que simplemente añadir un gas inerte para aumentar la presión total no acelerará su reacción objetivo.
- Si su objetivo principal es alterar la velocidad de una reacción en un líquido o sólido: Manipular la presión no es una estrategia viable; debe centrarse en cambiar la temperatura, la concentración de las especies disueltas o utilizar un catalizador.
Al comprender que la presión es un sustituto de la concentración en los gases, obtendrá un control preciso sobre la cinética de su sistema.
Tabla resumen:
| Factor | Efecto en reacciones gaseosas | Efecto en reacciones líquidas/sólidas |
|---|---|---|
| Aumento de presión | Aumenta la concentración y la frecuencia de colisión | Efecto insignificante (incompresible) |
| Presión parcial | Controla directamente la velocidad de reacción | No aplicable |
| Adición de gas inerte | No hay aumento de velocidad (presión parcial constante) | No aplicable |
| Temperatura vs. Presión | La presión afecta la frecuencia; la temperatura afecta la frecuencia y la energía | La temperatura es el factor de control principal |
¿Necesita controlar con precisión sus reacciones químicas? KINTEK se especializa en equipos de laboratorio de alta calidad, incluidos reactores a presión y sistemas de manipulación de gases, para ayudarle a optimizar la cinética de reacción y lograr resultados superiores en su laboratorio. Contacte hoy mismo con nuestros expertos para analizar su aplicación específica y descubrir la solución adecuada para sus necesidades.
Guía Visual
Productos relacionados
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Mini Reactor Autoclave de Alta Presión SS para Uso en Laboratorio
- Reactor de Presión de Laboratorio Autoclave de Alta Presión de Acero Inoxidable
- Reactor Autoclave de Laboratorio de Alta Presión para Síntesis Hidrotermal
- Máquina de prensa isostática en frío de laboratorio eléctrico dividida para prensado isostático en frío
La gente también pregunta
- ¿Cuál es el papel de los reactores de alta presión en el estudio de la oxidación de aleaciones? Herramientas esenciales para la investigación supercrítica
- ¿Por qué son necesarios los recipientes de reacción sellados de laboratorio en la síntesis hidrotermal de zeolitas? Asegurar la pureza y el rendimiento
- ¿Cuál es el propósito de usar un reactor hidrotermal de alta temperatura? Mejora la síntesis de cátodos de yodo en carbón activado
- ¿Cuál es la función de un reactor hidrotermal de temperatura constante? Dominio de la Activación de Cenizas Volantes de Carbón
- ¿Cómo demuestra su valor un reactor de alta presión en el envejecimiento acelerado? Predicción rápida de la durabilidad del catalizador



















