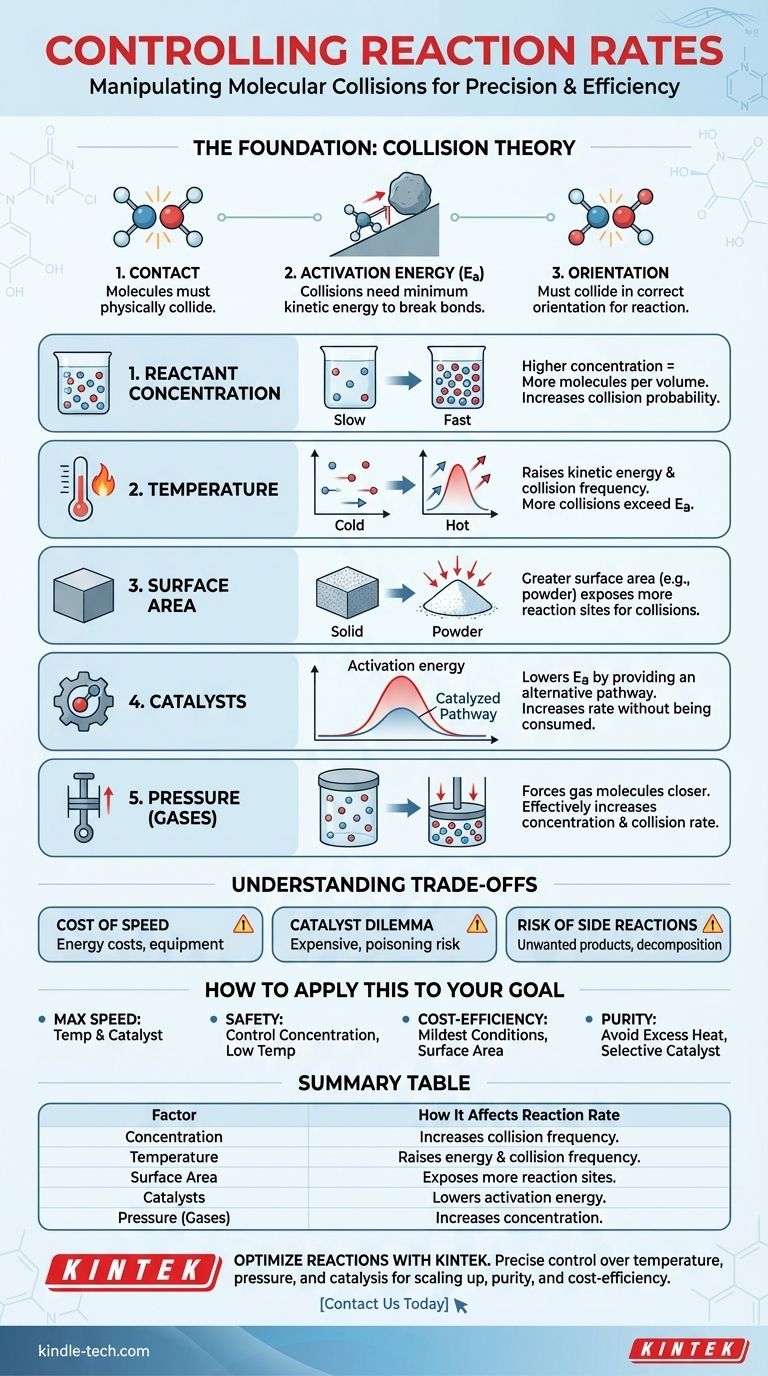
En esencia, cinco factores principales controlan la velocidad de una reacción química: la concentración de los reactivos, la temperatura, el estado físico y el área de superficie de los reactivos, la presencia de un catalizador y, para los gases, la presión. Cada uno de estos factores influye en la frecuencia y la energía de las colisiones moleculares, que es el motor fundamental de todo cambio químico.
La velocidad de cualquier reacción química está determinada por la frecuencia con la que las moléculas de los reactivos chocan con la orientación correcta y con suficiente energía para superar la barrera de energía de activación de la reacción. Todo lo que controla las velocidades de reacción es simplemente una palanca para manipular la frecuencia y la eficacia de estas colisiones.

La base: la teoría de colisiones
Para controlar una reacción, primero debes entender que las reacciones no son eventos instantáneos. Son el resultado de interacciones físicas entre moléculas. Esto se explica por la Teoría de Colisiones.
La necesidad de contacto
Para que ocurra una reacción, las moléculas de los reactivos deben chocar físicamente entre sí. Si están en recipientes separados, no puede ocurrir ninguna reacción. La velocidad de la reacción está directamente ligada a la velocidad de estas colisiones.
El requisito de energía (energía de activación)
Una colisión por sí sola no es suficiente. Las moléculas que chocan deben poseer una cantidad mínima de energía cinética, conocida como energía de activación (Ea). Esta energía es necesaria para romper los enlaces químicos existentes y que se puedan formar otros nuevos.
Piensa en la energía de activación como una colina sobre la que debes empujar una roca. Un empujón suave (una colisión de baja energía) no hará nada. Necesitas proporcionar suficiente empuje (energía suficiente) para llevarla a la cima de la colina, después de lo cual puede rodar por el otro lado y liberar energía.
El factor de orientación
Finalmente, las moléculas deben chocar en una orientación específica que permita que los enlaces correctos se rompan y se formen otros nuevos. Una colisión aleatoria en el ángulo incorrecto, incluso si es lo suficientemente energética, no resultará en una reacción.
Las cinco palancas para controlar la velocidad de reacción
Comprender la teoría de colisiones te da cinco palancas distintas para acelerar o ralentizar una reacción. Cada una funciona influyendo en la frecuencia de colisión, la energía de colisión o la propia barrera de energía de activación.
1. Concentración de reactivos
Aumentar la concentración de los reactivos significa que hay más moléculas empaquetadas en un volumen dado. Esto aumenta directamente la probabilidad de que choquen, aumentando así la velocidad de reacción.
2. Temperatura
Elevar la temperatura tiene un efecto potente y doble. Primero, aumenta la energía cinética de las moléculas, haciéndolas moverse más rápido y chocar con más frecuencia. Segundo, y más importante, aumenta la energía de estas colisiones, lo que significa que un porcentaje mayor de ellas tendrá suficiente energía para superar la barrera de energía de activación.
3. Estado físico y área de superficie
Esto es más relevante para reacciones que involucran diferentes fases, como un sólido reaccionando con un líquido (reacciones heterogéneas). Un bloque sólido tiene un área de superficie limitada donde pueden ocurrir colisiones. Moler ese mismo bloque hasta convertirlo en un polvo fino aumenta drásticamente su área de superficie, exponiendo más moléculas y creando muchos más sitios para que ocurran las reacciones.
4. Catalizadores
Un catalizador aumenta la velocidad de reacción sin consumirse en el proceso. Lo hace proporcionando una vía de reacción alternativa con una energía de activación más baja.
Volviendo a nuestra analogía, un catalizador es como construir un túnel a través de la colina. Ya no necesitas empujar la roca hasta la cima; puedes llevarla al otro lado con mucho menos esfuerzo. Esto permite que más moléculas reaccionen con éxito, incluso a temperaturas más bajas.
5. Presión (para reacciones gaseosas)
Para reacciones que involucran gases, aumentar la presión fuerza a las moléculas de gas a acercarse. Esto es efectivamente lo mismo que aumentar su concentración, lo que lleva a colisiones más frecuentes y una velocidad de reacción más rápida.
Comprendiendo las compensaciones
Manipular las velocidades de reacción no está exento de consecuencias. Un asesor técnico eficaz debe considerar las implicaciones prácticas y económicas de cada elección.
El costo de la velocidad
Aumentar la temperatura y la presión requiere energía, lo que cuesta dinero. También puede exigir reactores especializados de alta presión que son caros de construir y mantener, lo que introduce consideraciones de seguridad.
El dilema del catalizador
Los catalizadores pueden ser muy eficaces, pero a menudo son caros (por ejemplo, el uso de metales preciosos como el platino o el paladio). También pueden ser muy específicos para una reacción y pueden inactivarse por impurezas, un proceso conocido como "envenenamiento del catalizador".
Riesgo de reacciones secundarias no deseadas
Forzar demasiado una reacción, especialmente con calor excesivo, puede llevar a resultados indeseables. Los reactivos o productos podrían comenzar a descomponerse, o el aumento de energía puede permitir reacciones secundarias no deseadas, reduciendo la pureza y el rendimiento del producto deseado.
Cómo aplicar esto a tu objetivo
Tu estrategia para controlar una reacción depende completamente de lo que intentes lograr.
- Si tu objetivo principal es la máxima velocidad: Las palancas más potentes son aumentar la temperatura y usar un catalizador eficaz, ya que ambos aumentan drásticamente el número de colisiones exitosas y energéticas.
- Si tu objetivo principal es la seguridad y el control: Gestionar cuidadosamente la concentración de los reactivos (por ejemplo, añadiendo un reactivo lentamente a otro) y usar la temperatura efectiva más baja son los mejores enfoques.
- Si tu objetivo principal es la rentabilidad: Optimiza para las condiciones más suaves posibles. Esto puede implicar encontrar un catalizador asequible o aumentar el área de superficie para evitar los altos costos energéticos del calor y la presión extremos.
- Si tu objetivo principal es la pureza del producto: Evita temperaturas excesivamente altas que puedan causar descomposición o reacciones secundarias, y asegúrate de que tu catalizador sea altamente selectivo para la reacción deseada.
En última instancia, controlar una reacción química es el arte de gestionar con precisión las condiciones que rigen las colisiones moleculares.
Tabla resumen:
| Factor | Cómo afecta la velocidad de reacción |
|---|---|
| Concentración | Una mayor concentración aumenta la frecuencia de colisión entre las moléculas de los reactivos. |
| Temperatura | Aumenta la energía molecular y la frecuencia de colisión; más colisiones superan la energía de activación. |
| Área de superficie | Una mayor área de superficie (por ejemplo, sólido en polvo) expone más sitios de reacción para las colisiones. |
| Catalizadores | Reduce la energía de activación al proporcionar una vía de reacción alternativa. |
| Presión (Gases) | Aumenta la concentración de moléculas de gas, lo que lleva a colisiones más frecuentes. |
Optimiza tus reacciones químicas con equipos de precisión de KINTEK. Ya sea que estés aumentando la producción, asegurando la pureza del producto o maximizando la rentabilidad, nuestro equipo de laboratorio y consumibles están diseñados para darte un control preciso sobre las condiciones de reacción. Deja que nuestros expertos te ayuden a seleccionar las herramientas adecuadas para gestionar la temperatura, la presión y la catálisis para tus necesidades específicas. Contáctanos hoy para discutir cómo podemos apoyar el éxito de tu laboratorio.
Guía Visual
Productos relacionados
- Mini Reactor Autoclave de Alta Presión SS para Uso en Laboratorio
- Reactor de Presión de Laboratorio Autoclave de Alta Presión de Acero Inoxidable
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Máquina de prensa hidráulica automática con calefacción y placas calientes para prensa caliente de laboratorio 25T 30T 50T
La gente también pregunta
- ¿Cuál es el propósito de usar gas argón de alta pureza en un reactor de alta presión? Asegurar datos precisos de pruebas de corrosión
- ¿Cuáles son las condiciones que se mantienen en un biorreactor? Dominar la temperatura, el pH, el oxígeno y la agitación para un crecimiento celular óptimo
- ¿Cómo mejora un reactor de acero inoxidable la fotodegradación de metotrexato? Acelere la velocidad de reacción con óptica
- ¿Qué condiciones de proceso proporciona un Reactor Hidrotermal para la síntesis de HA mesoporosa? Dominio del Control de Alta Presión
- ¿Cuáles son las ventajas de usar un reactor cilíndrico de acero inoxidable? Maximizar la eficiencia fotocatalítica
- ¿Cuál es la función de un reactor de síntesis hidrotermal de alta presión? Ingeniería de electrodos de aerogel de carbono
- ¿Por qué se prefieren los reactores giratorios para la lixiviación de metales? Mejore la eficiencia y el rendimiento de la recuperación de residuos electrónicos.
- ¿Cómo afecta la presión a la velocidad de reacción en cinética química? Control maestro de la reacción de gases



