En ingeniería química, el aumento de la presión en un reactor se logra fundamentalmente manipulando las variables de la Ley de los Gases Ideales (PV=nRT). Los métodos más comunes son introducir más material (gas), aumentar la temperatura del sistema o reducir mecánicamente el volumen del reactor. Cada método cumple un propósito distinto y conlleva implicaciones significativas para la cinética, el equilibrio y la seguridad general de la reacción.
El desafío principal no es simplemente cómo aumentar la presión, sino por qué se está haciendo. Elegir el método correcto depende totalmente de si su objetivo es aumentar la concentración de reactivos, desplazar el equilibrio químico o controlar la fase de los materiales dentro del reactor.

Principios Fundamentales de la Generación de Presión
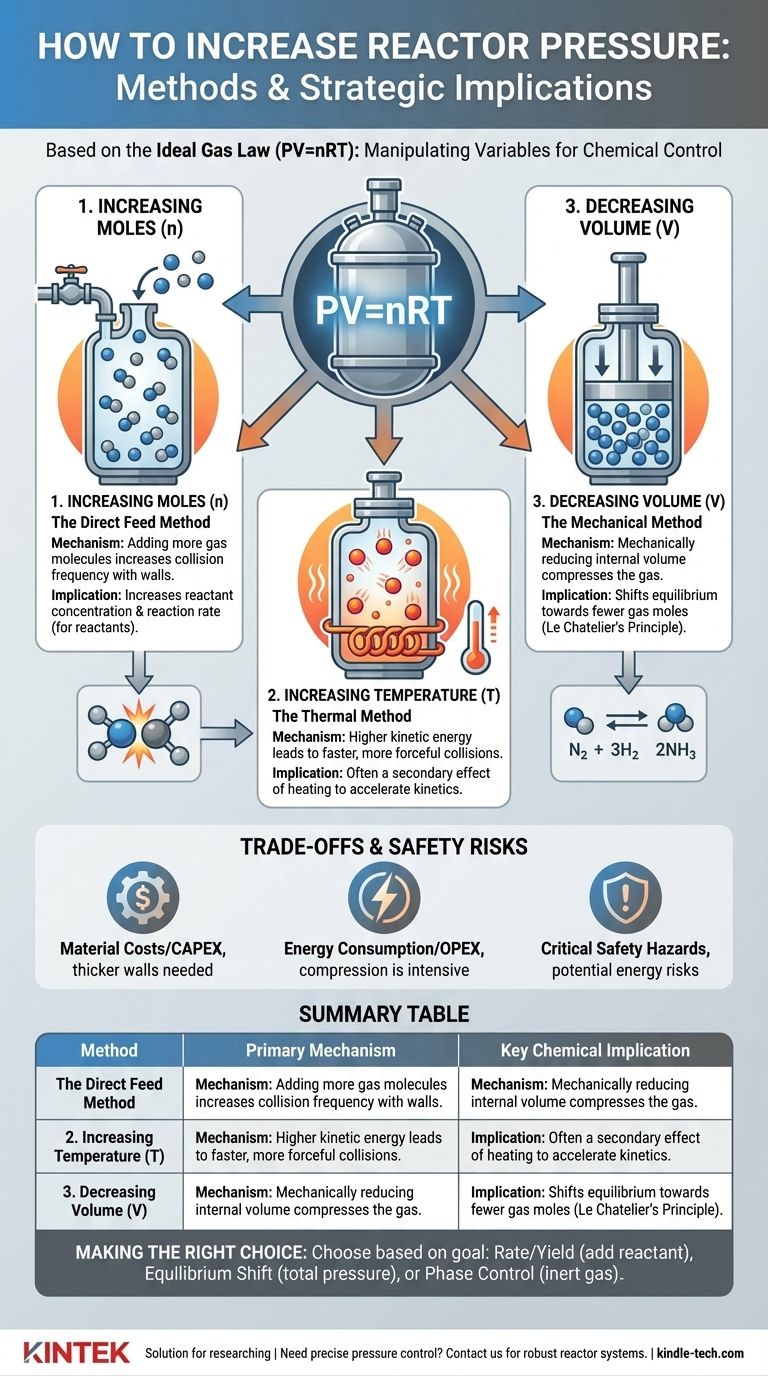
En esencia, la presión es el resultado de las colisiones de las moléculas de gas contra las paredes de un recipiente. Para aumentar esta presión, debe hacer que esas colisiones sean más frecuentes o más fuertes. La Ley de los Gases Ideales proporciona el marco teórico para cómo se logra esto.
Aumento de Moles (n): El Método de Alimentación Directa
Este es el enfoque más directo. Al añadir más moléculas de gas a un volumen fijo, se aumenta el número de colisiones con las paredes del reactor, elevando así la presión.
Sin embargo, existe una distinción crítica entre añadir un reactivo y añadir un gas inerte. Añadir más de un reactivo gaseoso aumenta su presión parcial, lo que incrementa directamente su concentración y puede acelerar la velocidad de reacción.
Por el contrario, añadir un gas inerte (como nitrógeno o argón) aumenta la presión total del sistema, pero no modifica las presiones parciales de los reactivos. Esta técnica se utiliza a menudo para controlar el comportamiento de las fases o para la gestión del calor, no para influir directamente en la velocidad de reacción.
Aumento de la Temperatura (T): El Método Térmico
Calentar un reactor sellado aumenta la energía cinética de las moléculas de gas en su interior. Estas moléculas energizadas se mueven más rápido, lo que provoca colisiones más frecuentes y más fuertes contra las paredes del reactor, lo que se manifiesta como un aumento de la presión.
Este método suele ser un efecto secundario de operar una reacción a una temperatura más alta para aumentar su velocidad. El aumento de la presión debe anticiparse y gestionarse como parte del diseño del reactor.
Disminución del Volumen (V): El Método Mecánico
Para ciertos tipos de reactores, la presión se puede aumentar reduciendo mecánicamente el volumen interno. Piense en un pistón en un cilindro que comprime un gas.
Este método es menos común en reactores continuos a gran escala, pero es un principio primario en ciertos montajes de laboratorio, procesos por lotes y tipos específicos de compresores o motores.
Implicaciones Químicas de una Presión Más Alta
Aumentar la presión es una herramienta poderosa utilizada para influir y controlar el resultado de una reacción química. No es simplemente un parámetro físico, sino un motor clave del comportamiento químico.
Impacto en la Velocidad de Reacción
Para la mayoría de las reacciones en fase gaseosa, aumentar la presión añadiendo más reactivos obliga a las moléculas a estar más juntas. Esta mayor concentración conduce a colisiones moleculares más frecuentes, lo que generalmente resulta en una velocidad de reacción más rápida.
Impacto en el Equilibrio
Esto se rige por el Principio de Le Chatelier. Si una reacción reversible tiene un número diferente de moles de gas en el lado de los reactivos y de los productos, cambiar la presión desplazará el equilibrio.
Aumentar la presión favorecerá el lado de la reacción con menos moles de gas. El ejemplo clásico es el proceso Haber-Bosch para la síntesis de amoníaco (N₂ + 3H₂ ⇌ 2NH₃), donde se utiliza alta presión para desplazar el equilibrio hacia el producto, el amoníaco.
Impacto en el Comportamiento de Fase
La presión es también una herramienta fundamental para controlar el estado físico de las sustancias. Una presión alta puede evitar que un líquido hierva, incluso a altas temperaturas, lo cual es esencial para muchas reacciones en fase líquida. También se puede utilizar para licuar gases para su separación o para facilitar reacciones que ocurren en la interfaz entre un gas y un líquido.
Comprensión de las Compensaciones y Riesgos de Seguridad
Si bien una presión más alta puede ofrecer ventajas significativas en el proceso, conlleva costos y peligros sustanciales que deben gestionarse cuidadosamente.
Costos de Materiales y Construcción
Los reactores de alta presión exigen paredes de acero más gruesas, aleaciones más avanzadas y sellos y accesorios altamente especializados para garantizar la contención. Esto aumenta drásticamente el gasto de capital inicial (CAPEX) de un proyecto.
Consumo de Energía
Comprimir gases a altas presiones es un proceso extremadamente intensivo en energía. Esto se traduce directamente en un mayor gasto operativo continuo (OPEX) y puede tener un impacto significativo en la viabilidad económica de un proceso.
Riesgos Críticos de Seguridad
La consideración más importante es la seguridad. Un sistema de alta presión almacena una gran cantidad de energía potencial. Una rotura o fallo puede provocar una liberación explosiva y catastrófica.
Todos los sistemas de alta presión deben estar equipados con múltiples capas de seguridad, incluidas válvulas de alivio de presión, discos de ruptura y protocolos rigurosos de inspección y mantenimiento para mitigar estos riesgos.
Tomar la Decisión Correcta para su Objetivo
El método correcto para aumentar la presión está dictado por el objetivo específico de su proceso químico.
- Si su enfoque principal es aumentar la velocidad de reacción y el rendimiento: Añadir directamente más reactivo gaseoso es la estrategia más eficaz, ya que aumenta las presiones parciales que impulsan la reacción.
- Si su enfoque principal es desplazar un equilibrio químico: Aumentar la presión total del sistema, ya sea mediante compresión o añadiendo reactivos, es fundamental para las reacciones en las que el lado del producto tiene menos moles de gas.
- Si su enfoque principal es mantener una fase líquida por encima de su punto de ebullición normal: Aumentar la presión total, a menudo con un gas inerte, es la clave para crear las condiciones de proceso necesarias.
En última instancia, controlar la presión del reactor consiste en manipular estratégicamente la termodinámica y la cinética del sistema para lograr el resultado deseado de manera segura y eficiente.
Tabla Resumen:
| Método | Mecanismo Principal | Implicación Química Clave |
|---|---|---|
| Aumento de Moles (n) | Adición de más moléculas de gas | Aumenta la concentración de reactivos/velocidad de reacción |
| Aumento de Temperatura (T) | Elevación de la energía cinética molecular | Efecto secundario de calentar para acelerar reacciones |
| Disminución del Volumen (V) | Compresión mecánica del gas | Desplaza el equilibrio hacia menos moles de gas |
¿Necesita un control preciso de la presión para sus procesos de laboratorio? KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluidos sistemas de reactores robustos diseñados para una gestión segura y eficiente de la presión. Nuestras soluciones le ayudan a lograr una cinética de reacción, un rendimiento y una seguridad óptimos. Contacte con KINTEK hoy mismo para analizar cómo podemos apoyar las necesidades específicas de su laboratorio.
Guía Visual
Productos relacionados
- Reactores de Laboratorio Personalizables de Alta Temperatura y Alta Presión para Diversas Aplicaciones Científicas
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Autoclave de vapor horizontal de alta presión de laboratorio para uso en laboratorio
- Reactor Autoclave de Laboratorio de Alta Presión para Síntesis Hidrotermal
- Autoclave de vapor de alta presión de laboratorio vertical para departamento de laboratorio
La gente también pregunta
- ¿Cuál es la función de un autoclave hidrotérmico revestido de PTFE en la síntesis de cys-CDs? Lograr puntos cuánticos de carbono de alta pureza
- ¿Qué papel juega un reactor de alta presión en la hidrodesoxigenación (HDO) del bioaceite? Impulsando la mejora profunda de combustibles
- ¿Por qué es necesaria una autoclave de síntesis hidrotermal de alta presión para los nanocables de MnO2? Crecimiento preciso de catalizadores
- ¿Por qué utilizar reactores de alta presión para el pretratamiento de residuos alimentarios? ¡Aumente la eficiencia de la producción de hidrógeno hoy mismo!
- ¿Por qué los reactores de tubo de aleación de alta resistencia son críticos para HHIP? Garantizar la seguridad y la pureza en entornos de alta presión



















