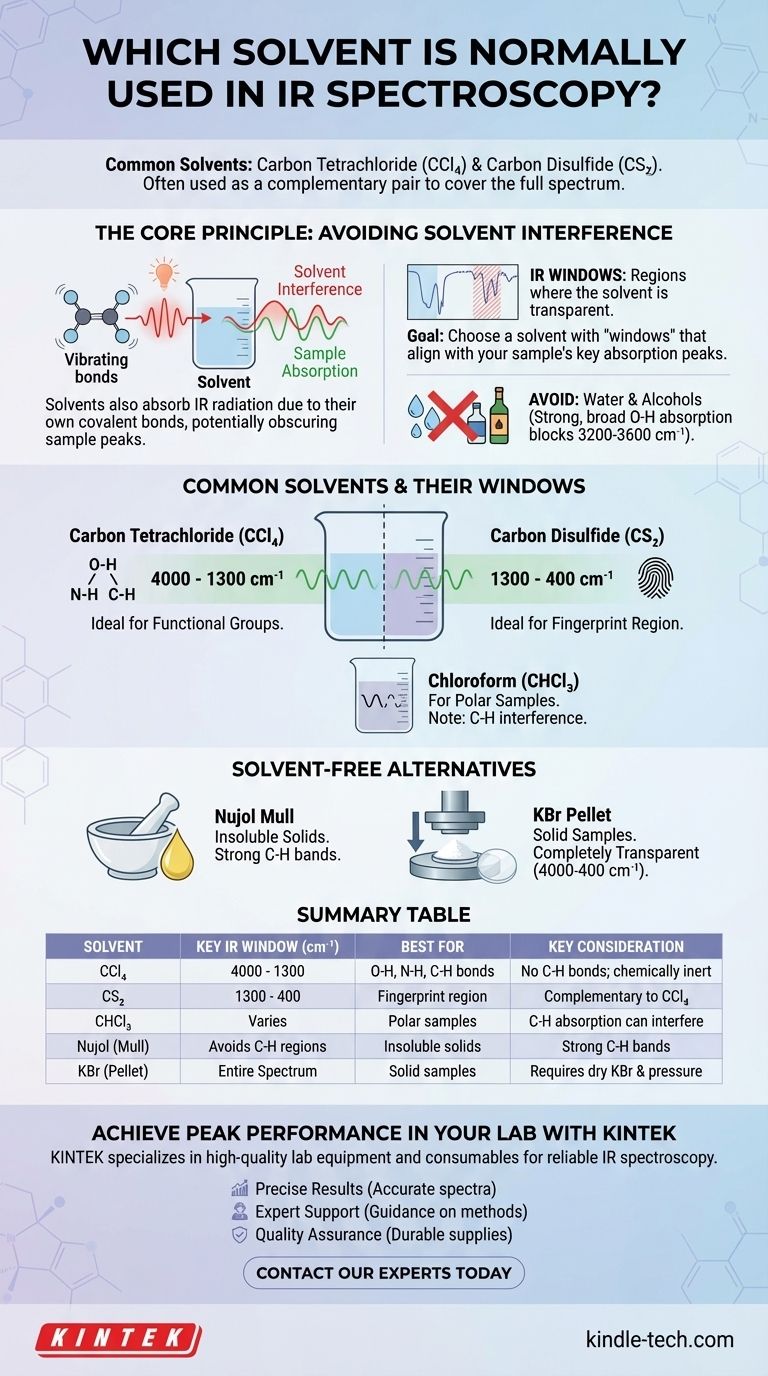
Los disolventes más comunes para la espectroscopia IR son el tetracloruro de carbono (CCl₄) y el disulfuro de carbono (CS₂). Dado que ningún disolvente es transparente en todo el espectro infrarrojo, estos dos se utilizan a menudo como un par complementario para analizar diferentes regiones. La elección del disolvente es crítica, ya que el objetivo es disolver la muestra sin que las propias vibraciones moleculares del disolvente oscurezcan las bandas de absorción de la muestra.
El principio fundamental de la selección de disolventes en la espectroscopia IR es encontrar un medio que disuelva su compuesto pero que sea "invisible" en la región espectral que le interesa. Dado que no existe un disolvente perfecto, el proceso implica elegir estratégicamente un disolvente con "ventanas" transparentes conocidas que se alineen con los picos de absorción clave de su muestra.

El Principio Fundamental: Evitar la Interferencia del Disolvente
La espectroscopia infrarroja funciona midiendo las vibraciones de los enlaces moleculares. El desafío es que los enlaces covalentes dentro de cualquier molécula de disolvente también absorberán la radiación IR, creando sus propios picos espectrales que pueden interferir o enmascarar completamente los picos de su muestra.
Por qué los Disolventes Absorben la Radiación IR
Al igual que su muestra, las moléculas de disolvente están formadas por átomos conectados por enlaces covalentes. Estos enlaces (como C-H, C-Cl, C=S) se estiran y doblan a frecuencias específicas cuando absorben luz infrarroja. Esta absorción es la fuente de interferencia.
El Concepto de "Ventanas IR"
Ningún disolvente es transparente en todo el rango del IR medio (4000 – 400 cm⁻¹). Sin embargo, cada disolvente tiene regiones donde absorbe solo débilmente o no absorbe en absoluto. Estas áreas se denominan "ventanas IR".
El objetivo es elegir un disolvente cuyas ventanas coincidan con las regiones de absorción de los grupos funcionales que desea estudiar en su muestra.
El Problema del Agua y los Alcoholes
Los disolventes con grupos -OH, como el agua y el etanol, casi nunca se utilizan para IR. El enlace O-H produce una banda de absorción intensamente fuerte y amplia que oscurece completamente una vasta e importante región del espectro (aproximadamente 3200-3600 cm⁻¹), lo que imposibilita ver cualquier pico de muestra en esa área.
Disolventes Comunes y Sus Ventanas
Para obtener un espectro completo, los químicos a menudo realizan dos escaneos de la misma muestra: uno en un disolvente que es transparente en la región de alta frecuencia y otro en un disolvente que es transparente en la región de "huella dactilar" de baja frecuencia.
Tetracloruro de Carbono (CCl₄)
Esta es la elección estándar para la región de 4000 cm⁻¹ a 1300 cm⁻¹. Debido a que no tiene enlaces C-H, es transparente donde ocurren las vibraciones de estiramiento C-H, N-H y O-H, lo que lo hace ideal para analizar estos grupos funcionales críticos.
Disulfuro de Carbono (CS₂)
Este es el disolvente complementario al CCl₄. Es en gran parte transparente en la región de huella dactilar de 1300 cm⁻¹ a 400 cm⁻¹. Esto permite un análisis detallado de las vibraciones complejas que le dan a una molécula su identidad espectral única.
Cloroformo (CHCl₃)
El cloroformo es un disolvente más polar y puede ser una buena opción si su muestra no se disuelve en CCl₄ o CS₂. Sin embargo, su propio enlace C-H crea bandas de absorción (alrededor de 3000 cm⁻¹ y 1200 cm⁻¹) que pueden interferir con el análisis de los enlaces C-H en la muestra.
Comprendiendo las Ventajas y Desventajas y las Alternativas
Elegir un disolvente es solo una forma de preparar una muestra. Si su compuesto es insoluble o si la interferencia del disolvente es inevitable, existen otras técnicas estándar.
La Inercia Química es Innegociable
Como señala el material de referencia, el disolvente no debe reaccionar con su muestra. Usar un disolvente ácido para una muestra básica, por ejemplo, resultaría en un par iónico, y estaría analizando el espectro de una especie química completamente diferente de la que pretendía.
La Pasta de Nujol: Una Alternativa sin Disolventes
Cuando una muestra es insoluble en todos los disolventes IR adecuados, la pasta de Nujol es la técnica preferida. La muestra sólida se muele hasta obtener un polvo fino y se mezcla con una gota de Nujol (un aceite mineral) para formar una pasta.
Esta pasta se prensa luego entre dos placas de sal para su análisis. El Nujol en sí mismo consiste en hidrocarburos de cadena larga, por lo que mostrará fuertes bandas de absorción C-H, pero es transparente en otros lugares, lo que permite el análisis de la mayoría de los otros grupos funcionales.
La Pastilla de KBr
Otro método común sin disolventes es la pastilla de KBr. La muestra sólida se mezcla con polvo de bromuro de potasio (KBr) puro y seco y se prensa a alta presión para formar un disco pequeño y transparente. El KBr tiene enlaces iónicos y no absorbe la radiación IR, lo que lo convierte en un medio completamente transparente para el análisis.
Tomando la Decisión Correcta para Su Análisis
Su elección del método de preparación de la muestra depende completamente de las propiedades físicas de su muestra y de la información específica que necesite del espectro.
- Si su enfoque principal está en los enlaces O-H, N-H o C-H (4000-1300 cm⁻¹): Use tetracloruro de carbono (CCl₄) por su excelente transparencia en esta región.
- Si su enfoque principal está en la región de huella dactilar (1300-400 cm⁻¹): Use disulfuro de carbono (CS₂) para obtener una vista clara de las vibraciones complejas únicas de su molécula.
- Si su muestra es insoluble en disolventes no polares: Considere una opción más polar como el cloroformo, o evite por completo los disolventes líquidos y prepare una pastilla de KBr o una pasta de Nujol.
En última instancia, una preparación eficaz de la muestra consiste en garantizar que el espectro que registra sea el de su compuesto, no un artefacto del medio elegido.
Tabla Resumen:
| Disolvente | Ventana IR Clave (cm⁻¹) | Mejor Para | Consideración Clave |
|---|---|---|---|
| Tetracloruro de Carbono (CCl₄) | 4000 - 1300 | Enlaces O-H, N-H, C-H | Sin enlaces C-H; químicamente inerte |
| Disulfuro de Carbono (CS₂) | 1300 - 400 | Región de huella dactilar | Complementario al CCl₄ |
| Cloroformo (CHCl₃) | Varía (ej., huecos alrededor de 3000 cm⁻¹) | Muestras polares | La absorción C-H puede interferir |
| Nujol (Pasta) | Evita las regiones C-H | Sólidos insolubles | Fuertes bandas C-H del Nujol |
| KBr (Pastilla) | Espectro completo (4000-400) | Muestras sólidas | Requiere KBr seco y alta presión |
Logre el Máximo Rendimiento en Su Laboratorio
Navegar por la selección de disolventes es solo un paso hacia un análisis preciso de materiales. KINTEK se especializa en proporcionar el equipo de laboratorio y los consumibles de alta calidad que necesita para una espectroscopia IR confiable y más allá.
Permítanos ayudarle a mejorar las capacidades de su laboratorio:
- Resultados Precisos: Asegure que la preparación de su muestra conduzca a espectros precisos y sin interferencias.
- Soporte Experto: Obtenga orientación sobre las herramientas y métodos adecuados para su aplicación específica.
- Garantía de Calidad: Confíe en nuestros suministros duraderos y confiables para un rendimiento constante.
¿Listo para optimizar sus procesos analíticos? Contacte a nuestros expertos hoy para discutir cómo KINTEK puede apoyar las necesidades únicas de su laboratorio en espectroscopia y análisis de materiales.
Guía Visual
Productos relacionados
- Crisol de evaporación para materia orgánica
- Dióxido de iridio IrO2 para electrólisis del agua
- Reactor Autoclave de Laboratorio de Alta Presión para Síntesis Hidrotermal
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
La gente también pregunta
- ¿Cuál es el papel de un agitador industrial en la coprecipitación de Mn-Ce/Al2O3? Garantiza la homogeneidad del catalizador y el control del pH
- ¿Cuál es la temperatura óptima para la sinterización? Encuentre el proceso térmico perfecto para su material
- ¿Cuáles son los diferentes tipos de fotogramas en la compresión? Una guía de los fotogramas I, P y B
- ¿Cuál es la diferencia entre un horno de flujo ascendente y uno horizontal? Encuentre el ajuste perfecto para el diseño de su hogar
- ¿Cuál es el propósito del tratamiento térmico posterior a la deposición a 700°C para recubrimientos de Al? Mejorar la resistencia a la oxidación
- ¿Qué material no puede ser tratado térmicamente? Comprendiendo los límites del endurecimiento y la transformación de fase
- ¿Qué dos tipos de tecnologías de calentamiento se utilizan en los tratamientos térmicos? Calentamiento por Combustión vs. Calentamiento Eléctrico Explicado
- ¿A qué temperatura se destila el THC por vía corta? Domine el rango de 180°C-200°C para la pureza





