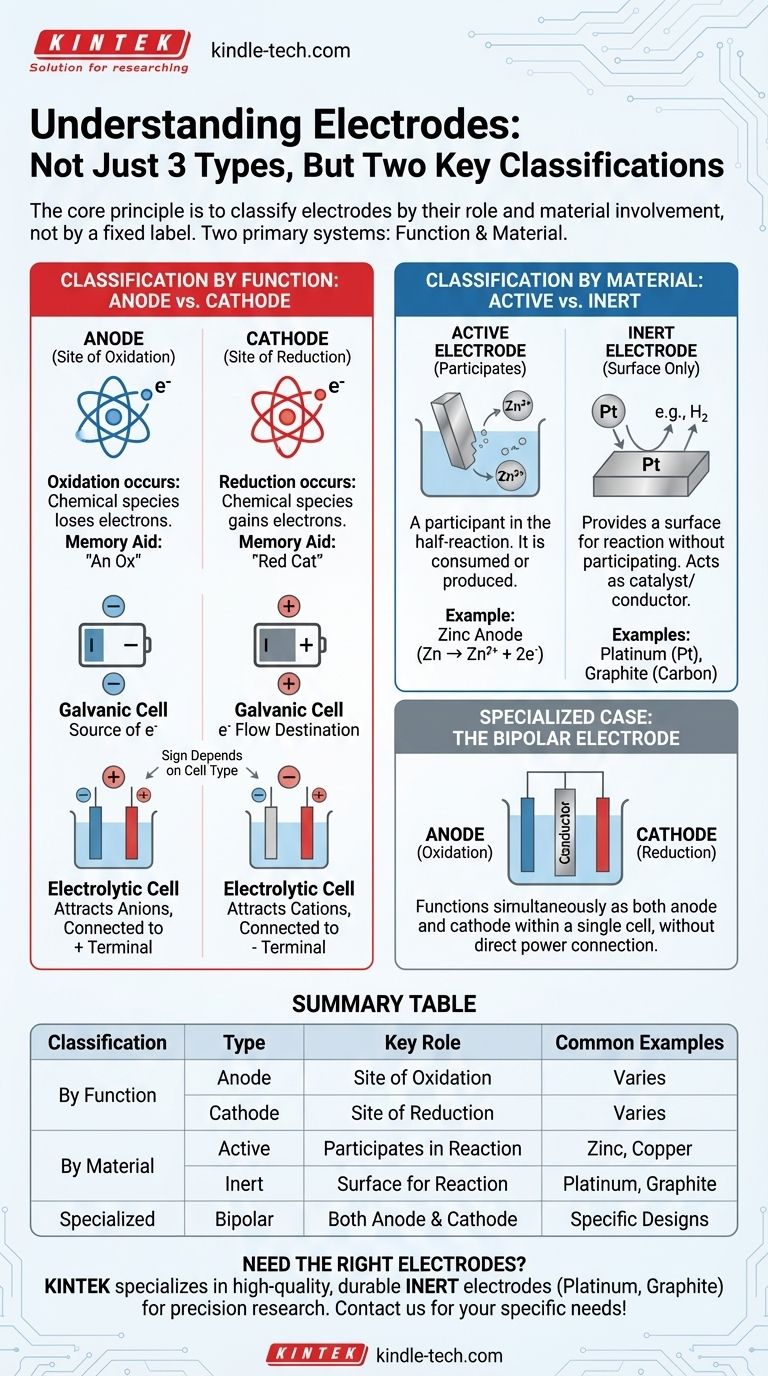
En electroquímica, los electrodos se entienden mejor no como tres tipos distintos, sino a través de dos sistemas de clasificación principales. El sistema más fundamental define un electrodo por su función: ya sea un ánodo, donde ocurre la oxidación, o un cátodo, donde ocurre la reducción. Un segundo sistema, igualmente importante, los clasifica por su composición material y su papel en la reacción: ya sea activo (participando en la reacción) o inerte (proporcionando una superficie para la reacción).
El principio central es clasificar los electrodos por su función, no por una etiqueta fija. Las dos clasificaciones más críticas se basan en la función (ánodo frente a cátodo) y la participación del material (activo frente a inerte). Comprender estos dos pares es la clave para analizar cualquier celda electroquímica.

Clasificación por Función: Ánodo frente a Cátodo
La forma más fundamental de definir un electrodo es por el proceso químico que ocurre en su superficie. Este papel puede cambiar dependiendo del flujo de electricidad.
El Ánodo: Sitio de Oxidación
El ánodo se define como el electrodo donde tiene lugar la oxidación. Este es un proceso en el que una especie química pierde electrones.
Una ayuda mnemotécnica simple es "An Ox" (Ánodo es Oxidación).
El Cátodo: Sitio de Reducción
El cátodo es el electrodo donde tiene lugar la reducción. Este es un proceso en el que una especie química gana electrones.
Una ayuda mnemotécnica correspondiente es "Red Cat" (Reducción en el Cátodo).
La Distinción Crítica: Signo frente a Función
Un punto común de confusión es si el ánodo y el cátodo son positivos o negativos. Esto depende enteramente del tipo de celda electroquímica.
En una Celda Galvánica (como una Batería)
Una celda galvánica produce electricidad a partir de una reacción espontánea.
- El Ánodo es el terminal Negativo (-). Es la fuente de electrones de la reacción de oxidación.
- El Cátodo es el terminal Positivo (+). Es donde fluyen los electrones para provocar la reacción de reducción.
En una Celda Electrolítica (como para Galvanoplastia)
Una celda electrolítica utiliza electricidad externa para impulsar una reacción no espontánea.
- El Ánodo es el terminal Positivo (+). Está conectado al extremo positivo de la fuente de alimentación, atrayendo aniones para ser oxidados.
- El Cátodo es el terminal Negativo (-). Está conectado al extremo negativo de la fuente de alimentación, atrayendo cationes para ser reducidos.
Clasificación por Material: Activo frente a Inerte
La segunda clasificación principal describe si el material del electrodo en sí es parte de la reacción química.
Electrodos Activos
Un electrodo activo (o electrodo reactivo) es un participante en la semirreacción. Está hecho de un material que se oxida o es el producto de una reducción.
Por ejemplo, en una batería de zinc-cobre, el ánodo de zinc se disuelve físicamente (se oxida) en iones de zinc (Zn → Zn²⁺ + 2e⁻). El electrodo en sí se consume.
Electrodos Inertes
Un electrodo inerte simplemente proporciona una superficie para que ocurra la oxidación o la reducción sin participar en la reacción en sí. Actúa como catalizador y conductor eléctrico.
Los electrodos inertes comunes incluyen el platino (Pt) y el grafito (carbono). Se utilizan cuando las especies que se oxidan o reducen son iones o gases en la solución.
Caso Especial: El Electrodo Bipolar
Un electrodo bipolar es un conductor especializado colocado en una solución electrolítica que no está conectado directamente a la fuente de alimentación.
Funciona simultáneamente como ánodo en el lado que mira al cátodo principal y como cátodo en el lado que mira al ánodo principal, permitiendo una serie de reacciones dentro de una sola celda.
Tomar la Decisión Correcta
Su comprensión de los electrodos debe guiar cómo analiza un sistema electroquímico. El "tipo" de electrodo se define por su contexto dentro de la celda.
- Si está analizando una batería (celda galvánica): Identifique el sitio de oxidación como el ánodo negativo y el sitio de reducción como el cátodo positivo.
- Si está analizando un proceso electrolítico (p. ej., galvanoplastia): Identifique el electrodo conectado al terminal positivo como el ánodo (oxidación) y el conectado al terminal negativo como el cátodo (reducción).
- Al diseñar un experimento: Debe decidir si necesita un electrodo activo que participe en la reacción o un electrodo inerte para simplemente facilitar una reacción entre especies ya presentes en la solución.
Al centrarse en la función y la participación del material, puede describir y predecir con precisión el comportamiento de cualquier electrodo en cualquier sistema electroquímico.
Tabla Resumen:
| Clasificación | Tipo | Función Clave | Ejemplos Comunes |
|---|---|---|---|
| Por Función | Ánodo | Sitio de Oxidación (pierde electrones) | Varía según el tipo de celda |
| Cátodo | Sitio de Reducción (gana electrones) | Varía según el tipo de celda | |
| Por Material | Activo | Participa en la reacción | Zinc, Cobre |
| Inerte | Proporciona superficie para la reacción (no reactivo) | Platino, Grafito | |
| Especializado | Bipolar | Funciona como ánodo y cátodo | Se utiliza en diseños de celdas específicos |
¿Necesita los electrodos adecuados para su aplicación electroquímica? KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluidos electrodos inertes duraderos hechos de platino y grafito, diseñados para la precisión y fiabilidad en su laboratorio. Permita que nuestros expertos le ayuden a seleccionar los componentes perfectos para su investigación o proceso. Contáctenos hoy para discutir sus necesidades específicas.
Guía Visual
Productos relacionados
- Electrodo de Hoja de Oro Electrodos de Oro para Electroquímica
- Electrodo Electroquímico de Disco Metálico
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo de Disco de Oro
La gente también pregunta
- ¿Cuál es la regla crítica para usar un electrodo de placa de oro? Asegúrese de que solo la superficie de oro entre en contacto con el electrolito
- ¿Qué precauciones se deben tomar para prevenir el daño mecánico a un electrodo de placa de oro? Proteja la integridad de sus datos
- ¿Cuál es el principio de funcionamiento de un electrodo de disco de oro en un sistema electroquímico? Desbloquee la precisión con una interfaz estable
- ¿Cuáles son las desventajas de los electrodos de oro? Limitaciones clave para sus proyectos de laboratorio
- ¿Cuáles son los aspectos clave para el mantenimiento y cuidado de un electrodo de placa de oro? Preservar el rendimiento y extender la vida útil



















