Descubrimientos históricos en electroquímica
El experimento de la rana de Galvani
En 1791, el científico italiano Luigi Galvani llevó a cabo un experimento revolucionario que vincularía para siempre la biología y la electroquímica. Durante la disección de la pata de una rana, Galvani observó que la pata se movía cuando entraba en contacto con dos metales diferentes. Esta observación aparentemente sencilla condujo a una profunda constatación: los tejidos biológicos podían generar señales eléctricas y responder a ellas.
Este descubrimiento no fue una mera curiosidad académica, sino que también tuvo implicaciones prácticas. El fenómeno observado por Galvani recibió posteriormente el nombre de "acción galvánica" y sentó las bases para el desarrollo de dispositivos como el galvanómetro, un instrumento utilizado para medir pequeñas corrientes eléctricas. Además, el proceso de galvanización -el recubrimiento de los metales para evitar la corrosión- fue bautizado en su honor, lo que subraya el impacto duradero de su trabajo.
El experimento de Galvani fue un momento crucial en la historia de la ciencia, ya que tendió un puente entre las ciencias de la vida y las ciencias físicas. Demostró que los sistemas biológicos podían entenderse a través de la lente de los principios electroquímicos, allanando el camino para futuros avances en ambos campos.
La invención de la pila voltaica por Volta
En 1799, Alessandro Volta, físico italiano, hizo un descubrimiento revolucionario que sentó las bases de los sistemas electroquímicos modernos. Inventó la primera fuente de energía química, conocida como pila voltaica, que consistía esencialmente en una pila de discos de cobre y zinc separados por un paño o cartón húmedo empapado en salmuera. Este sencillo pero ingenioso dispositivo podía generar una corriente eléctrica constante, marcando el comienzo de la generación práctica de electricidad.
El invento de Volta no tardó en cobrar importancia y estimuló la investigación sobre las posibles aplicaciones de esta nueva fuente de energía. Sólo un año más tarde, en 1800, William Nicholson y Anthony Carlisle utilizaron una pila voltaica para realizar la primera electrólisis de agua con éxito. Durante este experimento, observaron la precipitación de gases, concretamente hidrógeno y oxígeno, lo que confirmó la descomposición de las moléculas de agua en sus elementos constituyentes bajo la influencia de una corriente eléctrica.
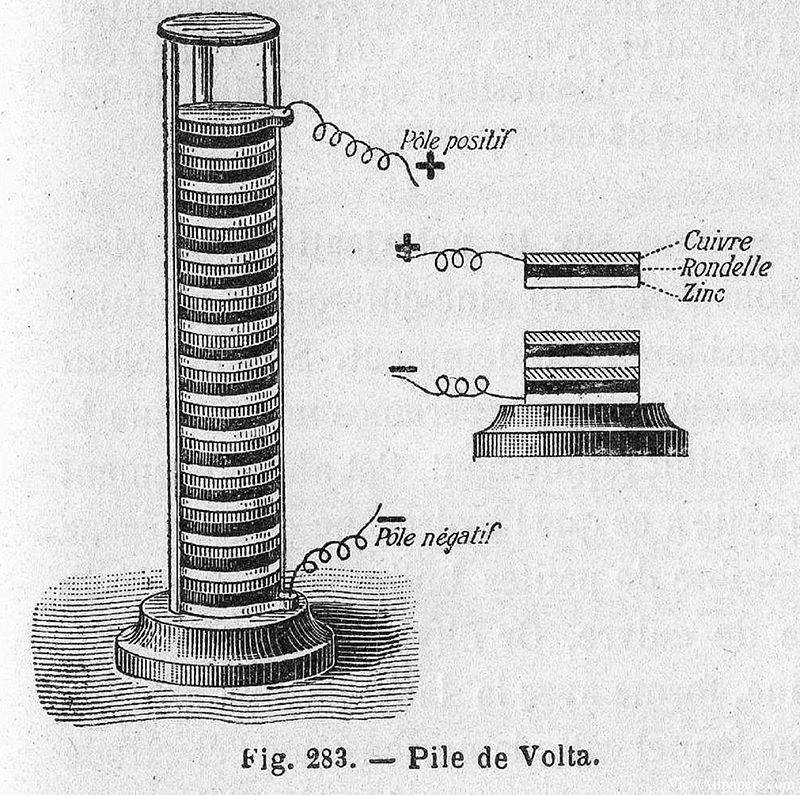
Este descubrimiento no sólo validó el concepto de electrólisis, sino que también demostró la utilidad práctica de la pila de Volta en la experimentación científica. La capacidad de descomponer compuestos en sus partes elementales utilizando electricidad abrió nuevas vías de investigación en química y física, allanando el camino para futuros avances en teoría y aplicaciones electroquímicas.
Éxitos de la electrólisis
En 1803, Humphry Davy logró un éxito revolucionario en el campo de la electroquímica al aislar con éxito los metales potasio y sodio mediante el proceso de electrólisis. Este monumental descubrimiento no sólo demostró la potencia de los métodos electroquímicos, sino que también allanó el camino para la producción de monómeros metálicos activos, esenciales en diversas aplicaciones industriales.
Los experimentos de Davy implicaban el uso de una pila voltaica, la primera fuente de energía química inventada por Alessandro Volta. Haciendo pasar una corriente eléctrica a través de sales fundidas, Davy pudo descomponer estos compuestos y obtener metales puros. Esta técnica supuso un avance significativo en la extracción de metales reactivos, que antes resultaban difíciles de aislar con los métodos químicos tradicionales.
Las implicaciones del trabajo de Davy se extendieron más allá del laboratorio. Su éxito en la electrólisis sentó las bases para futuras investigaciones en procesos electroquímicos, lo que condujo al desarrollo de métodos más eficaces para la extracción y purificación de metales. Este descubrimiento también puso de relieve el potencial de las técnicas electroquímicas en diversos sectores industriales, desde la metalurgia hasta la fabricación de productos químicos.
Además, los descubrimientos de Davy contribuyeron a una mayor comprensión de los principios electroquímicos, sentando las bases para posteriores avances teóricos como la Ley de Faraday de la electrólisis y la Ecuación de Nernst. Estos marcos teóricos, a su vez, permitieron realizar estudios cuantitativos más precisos de los fenómenos electroquímicos, haciendo avanzar aún más este campo.
En resumen, la exitosa electrólisis del potasio y el sodio realizada por Davy en 1803 fue un momento crucial en la historia de la electroquímica, ya que demostró las aplicaciones prácticas de los métodos electroquímicos y sentó las bases para futuras innovaciones en este campo.
Fundamentos teóricos de la electroquímica
La ley de Faraday de la electrólisis
En 1834, Michael Faraday, físico y químico pionero, formuló la ley de la electrólisis, piedra angular en el campo de la electroquímica. Esta ley proporcionó un marco cuantitativo para comprender y analizar los fenómenos electroquímicos, avanzando significativamente los fundamentos teóricos de la disciplina. El trabajo de Faraday fue decisivo para salvar la distancia entre las observaciones empíricas y los modelos teóricos, sentando las bases de futuros descubrimientos y aplicaciones en electroquímica.
La ley de Faraday de la electrólisis consta de dos principios fundamentales:
- Primera ley: La masa de una sustancia depositada o liberada en un electrodo durante la electrólisis es directamente proporcional a la cantidad de electricidad que pasa a través del electrolito.
- Segunda ley: La masa de una sustancia depositada o liberada en un electrodo durante la electrólisis es directamente proporcional al peso químico equivalente de la sustancia.
Estas leyes permitieron a los científicos medir con precisión la cantidad de material transformado durante una reacción electroquímica, facilitando el desarrollo de procedimientos y técnicas estandarizados en electroquímica. Al cuantificar la relación entre la corriente eléctrica, el tiempo y los cambios químicos resultantes, las leyes de Faraday proporcionaron un método sólido para estudiar y predecir los procesos electroquímicos.
El impacto del trabajo de Faraday fue más allá de la mera cuantificación. Sus leyes fomentaron una comprensión más profunda de los mecanismos subyacentes a la electrólisis, lo que a su vez dio lugar a avances en diversas aplicaciones prácticas. Estas aplicaciones abarcan desde procesos industriales como el refinado de metales y la galvanoplastia hasta el desarrollo de baterías y pilas de combustible, que forman parte integral de los sistemas energéticos modernos.
Además, las aportaciones de Faraday sentaron las bases de los posteriores avances teóricos en electroquímica. Sus leyes fueron fundamentales para el trabajo de científicos posteriores como Walther Nernst, que derivó la ecuación de Nernst, y Julius Tafel, que formuló la ecuación de Tafel. Estos avances refinaron aún más la comprensión de los potenciales de electrodo, la cinética de reacción y el comportamiento de los iones en solución, todos ellos aspectos críticos de la investigación electroquímica moderna.
En resumen, la ley de Faraday de la electrólisis no sólo revolucionó el estudio cuantitativo de los fenómenos electroquímicos, sino que también sentó una sólida base teórica para el floreciente campo de la electroquímica. Su trabajo sigue influyendo e inspirando la investigación y las aplicaciones contemporáneas, lo que subraya la importancia perdurable de sus contribuciones a la ciencia.
La ecuación de Nernst
En 1889, el químico alemán Walther Nernst realizó una contribución pionera al campo de la electroquímica al derivar una relación matemática que vinculaba el potencial del electrodo con la concentración de las sustancias implicadas en la reacción electroquímica. Esta relación, ahora conocida como ecuación de Nernst, se ha convertido en la piedra angular del estudio de los sistemas electroquímicos.
La ecuación de Nernst proporciona un medio cuantitativo para predecir el potencial de una célula electroquímica en condiciones no estándar, lo que resulta crucial para comprender y controlar los procesos electroquímicos. Se expresa como:
[ E = E^\circ - \frac{RT}{nF} \ln Q ]
donde:
- ( E ) es el potencial de electrodo.
- ( E^\circ ) es el potencial de electrodo estándar.
- ( R ) es la constante universal de los gases.
- ( T ) es la temperatura en Kelvin.
- ( n ) es el número de moles de electrones transferidos en la reacción.
- ( F ) es la constante de Faraday.
- ( Q ) es el cociente de reacción.
La ecuación demuestra cómo los cambios en la concentración pueden influir en el potencial de un electrodo, que es vital para aplicaciones que van desde el diseño de baterías a los procesos de electrólisis industrial. Al permitir a los científicos predecir y manipular los potenciales de los electrodos, la ecuación de Nernst ha hecho avanzar considerablemente nuestra capacidad para diseñar y optimizar sistemas electroquímicos.
Este descubrimiento no fue sólo un triunfo teórico, sino también práctico, ya que proporcionó a científicos e ingenieros una herramienta para comprender y controlar mejor el comportamiento de las células electroquímicas en diversas condiciones. La ecuación de Nernst sigue siendo una parte indispensable de la teoría y la práctica electroquímicas, lo que pone de relieve el profundo impacto del trabajo de Nernst en este campo.
Ecuación de Tafel
En 1905, Julius Tafel introdujo una fórmula empírica innovadora que establecía una relación directa entre la densidad de corriente y el sobrepotencial de hidrógeno. Esta ecuación, conocida como ecuación de Tafel, desempeñó un papel fundamental en el avance de nuestra comprensión de la cinética electroquímica. El trabajo de Tafel fue decisivo para dilucidar los mecanismos que subyacen a la velocidad de las reacciones electroquímicas, en particular las que implican la evolución del hidrógeno.
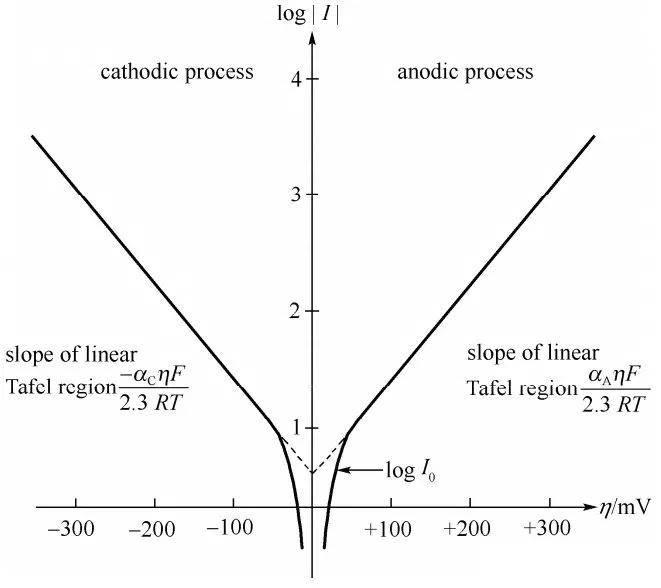
La ecuación de Tafel se expresa típicamente como:
$$ \eta = a + b \log(i) $$
donde
- (\eta) es el sobrepotencial,
- (i) es la densidad de corriente,
- (a) y (b) son constantes específicas del material del electrodo y de las condiciones de reacción.
La importancia de la ecuación de Tafel radica en su capacidad para describir cuantitativamente la velocidad de los procesos electroquímicos, lo que resulta crucial para optimizar los materiales de los electrodos y las condiciones de reacción. Esta ley empírica ha sido ampliamente validada y aplicada en diversos sistemas electroquímicos, desde la investigación básica hasta las aplicaciones industriales.
| Parámetro | Descripción |
|---|---|
| (\eta) | Sobrepotencial, el voltaje extra requerido más allá del potencial de equilibrio |
| (i) | Densidad de corriente, la corriente por unidad de área de la superficie del electrodo |
| (a) | Constante relacionada con la densidad de corriente de intercambio y el factor de simetría |
| (b) | Pendiente de Tafel, relacionada con el coeficiente de transferencia de carga |
El trabajo pionero de Tafel sentó las bases para la investigación posterior en cinética electroquímica, influyendo en el desarrollo de teorías y técnicas más sofisticadas. Su ecuación sigue siendo una piedra angular en este campo, poniendo de relieve la intrincada interacción entre los procesos eléctricos y químicos en electroquímica.
Cinética y técnicas electroquímicas
A partir de 1940, el campo de la electroquímica interfacial experimentó avances significativos, sobre todo en la comprensión de la estructura de la doble capa y la cinética de la precipitación de hidrógeno. Estos avances sentaron las bases de teorías y técnicas más sofisticadas en cinética electroquímica. Una de las aportaciones más notables de este periodo fue el establecimiento de la teoría microscópica de la transferencia de electrones de Marcus. Esta teoría proporcionó un marco detallado para comprender cómo se mueven los electrones a través de las interfaces, algo crucial para muchos procesos electroquímicos.
Los avances en cinética electroquímica no se limitaron a las construcciones teóricas. También evolucionaron las técnicas experimentales, lo que permitió a los investigadores sondear con mayor precisión el comportamiento de electrones e iones en las interfaces. Por ejemplo, el desarrollo de nuevos métodos espectroscópicos permitió observar en tiempo real las reacciones químicas que se producían en las superficies de los electrodos. Estas técnicas han sido fundamentales para validar y perfeccionar modelos teóricos, como la teoría de Marcus, al proporcionar datos empíricos que pueden compararse directamente con las predicciones teóricas.
Además, la interacción entre los avances teóricos y experimentales ha permitido desarrollar sistemas electroquímicos más eficaces. Por ejemplo, la comprensión de la cinética de precipitación del hidrógeno se ha aplicado al diseño de mejores pilas de combustible y baterías, esenciales para las modernas tecnologías de almacenamiento y conversión de energía. Estos sistemas se benefician de la mejora de la cinética, lo que se traduce en una mayor eficiencia y una vida útil más larga.
En resumen, el periodo que va de 1940 en adelante marcó una era de transformación de la cinética y las técnicas electroquímicas. La sinergia entre los conocimientos teóricos y las capacidades experimentales no sólo ha profundizado nuestra comprensión de los procesos fundamentales, sino que también ha allanado el camino para las aplicaciones prácticas en la energía y la ciencia de los materiales.
Técnicas electroquímicas in situ
Desde su aparición en la década de 1970, las técnicas electroquímicas in situ han revolucionado la exploración de los mecanismos electroquímicos. Estas técnicas permiten a los investigadores observar y analizar los procesos electroquímicos directamente en sus entornos operativos, proporcionando una visión sin precedentes de la dinámica de las reacciones en la interfaz electrodo-electrolito.
Uno de los avances más significativos en este campo es la integración de la espectroscopia de absorción de rayos X (XAS) electroquímica in situ. Este método permite monitorizar en tiempo real los cambios en la estructura electrónica y los estados de oxidación de los materiales durante las reacciones electroquímicas. Combinando la XAS con técnicas electroquímicas, los científicos pueden correlacionar las transformaciones estructurales con el rendimiento electroquímico, profundizando así nuestra comprensión de los procesos catalíticos y los materiales de electrodos.
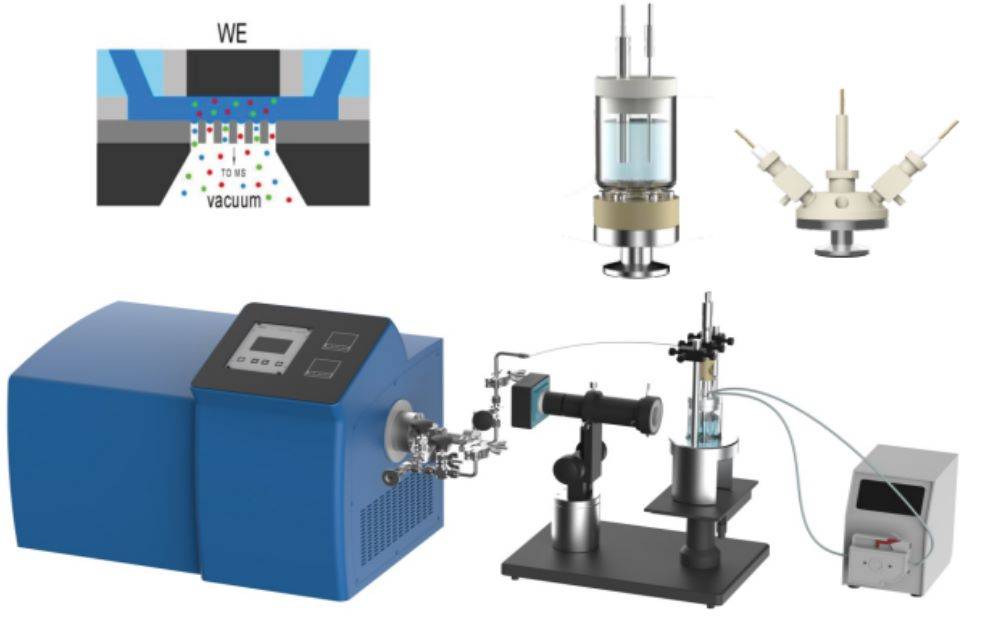
Además de la XAS, otras técnicas in situ, como la microscopía electroquímica de barrido (SECM) y la espectroscopia Raman in situ, también han cobrado importancia. La SECM permite la resolución espacial de los procesos electroquímicos a escala micrométrica, mientras que la espectroscopia Raman in situ proporciona información vibracional detallada sobre las especies implicadas en las reacciones.
La versatilidad y precisión de las técnicas electroquímicas in situ no sólo han mejorado la investigación fundamental, sino que también han acelerado el desarrollo de aplicaciones prácticas. Por ejemplo, estas técnicas son fundamentales para optimizar el rendimiento de baterías, pilas de combustible y electrocatalizadores. Al proporcionar datos en tiempo real sobre los intermedios de reacción y las modificaciones superficiales, los métodos in situ ayudan a diseñar dispositivos electroquímicos más eficaces y duraderos.
Además, la continua evolución de estas técnicas está ampliando su aplicabilidad. Los avances en la instrumentación y los métodos de análisis de datos están permitiendo una mayor resolución, una adquisición de datos más rápida y una interpretación más precisa de los resultados. Este progreso está allanando el camino para la próxima generación de investigación electroquímica, en la que las técnicas in situ desempeñarán un papel fundamental para desentrañar las complejidades de los sistemas electroquímicos.
Direcciones modernas en electroquímica
Mecanismos electroquímicos microscópicos
La exploración de los procesos electroquímicos a escala atómica y molecular es un punto central de la investigación contemporánea. Este campo emplea principalmente in situ y no in situ para diseccionar los intrincados mecanismos que rigen estos procesos. Estas técnicas permiten a los investigadores observar y analizar las reacciones electroquímicas en el momento en que se producen, lo que proporciona una visión sin precedentes de la dinámica en juego.
Uno de los principales avances en este campo es el uso de las técnicas espectroscopia electroquímica in situ de absorción de rayos X (XAS) . Este método permite controlar en tiempo real los cambios en la estructura electrónica y los estados de oxidación de los materiales durante las reacciones electroquímicas. Por ejemplo, la XAS puede revelar cómo cambia la superficie de un catalizador durante la catálisis de una reacción específica, lo que ofrece pistas para optimizar el catalizador y mejorar su rendimiento.
Además, microscopía de barrido en túnel (STM) y microscopía de fuerza atómica (AFM) han sido fundamentales para visualizar la morfología de la superficie y las propiedades electrónicas de los electrodos a nivel atómico. Estas técnicas han sido cruciales para comprender cómo los defectos superficiales, los adsorbatos y otras características microscópicas influyen en el comportamiento electroquímico de los materiales.
Para construir un mecanismo de reacción completo y racional, los investigadores suelen combinar estas observaciones microscópicas con modelos teóricos. Por ejemplo teoría funcional de la densidad (DFT) pueden predecir los paisajes energéticos de posibles vías de reacción, mientras que la dinámica molecular (DM) pueden modelizar el comportamiento temporal de iones y moléculas en el electrolito.
La integración de enfoques experimentales y teóricos ha dado lugar a importantes avances en este campo. Por ejemplo, el diseño racional de electrocatalizadores para la separación del agua y la reducción del CO₂ se ha basado en los conocimientos obtenidos a partir de estos esfuerzos combinados. Estos avances no sólo mejoran nuestra comprensión fundamental de los procesos electroquímicos, sino que también allanan el camino para el desarrollo de tecnologías energéticas más eficientes y sostenibles.
En resumen, el uso de técnicas avanzadas in situ y no in situ, junto con la modelización teórica, ha revolucionado el estudio de los mecanismos electroquímicos a nivel microscópico. Este enfoque interdisciplinario sigue impulsando la innovación tanto en la investigación académica como en las aplicaciones industriales.
Avances en los ensayos electroquímicos
Los métodos electroquímicos tradicionales están experimentando importantes transformaciones para satisfacer las demandas contemporáneas. Estos avances están impulsados por la necesidad de mejorar la sensibilidad de la monitorización, adaptarse a condiciones ambientales extremas e integrar sofisticados tratamientos matemáticos. La evolución de las técnicas de ensayo electroquímico no es una mera mejora incremental, sino un cambio de paradigma que tiende un puente entre la comprensión teórica y la aplicación práctica.
Una de las áreas clave del desarrollo es la integración de modelos matemáticos avanzados. Estos modelos permiten realizar predicciones e interpretaciones más precisas de los fenómenos electroquímicos, sobre todo en sistemas complejos en los que los métodos tradicionales se quedan cortos. Por ejemplo, la incorporación de algoritmos de aprendizaje automático ha permitido analizar y optimizar los procesos electroquímicos en tiempo real, reduciendo significativamente el tiempo y los recursos necesarios para la experimentación.

Además, la adaptabilidad de estos métodos a condiciones extremas ha abierto nuevas vías de investigación y aplicación. Ya se trate de las altas temperaturas de los procesos industriales o de las bajas temperaturas de la exploración espacial, las técnicas electroquímicas modernas se están adaptando para que funcionen con fiabilidad y eficacia. Esta adaptabilidad es crucial para industrias que van desde la producción de energía a la ciencia de los materiales, donde las condiciones pueden variar mucho.
Además de los avances matemáticos, los componentes de hardware de las pruebas electroquímicas también han experimentado notables mejoras. Los sensores de alta precisión y los sistemas automatizados son ya habituales, lo que permite una supervisión y recopilación de datos continuas. Estos sistemas no sólo son más precisos, sino también más fáciles de usar, lo que hace que los ensayos electroquímicos avanzados sean accesibles a una gama más amplia de investigadores e industrias.
La sinergia entre estos avances en modelización matemática, adaptabilidad medioambiental y mejoras del hardware ha dado lugar a una nueva era en las pruebas electroquímicas. Esta era se caracteriza por una mayor precisión, eficiencia y aplicabilidad, allanando el camino para avances tanto en la investigación fundamental como en las aplicaciones prácticas.
Aplicaciones interdisciplinarias
La versatilidad de la electroquímica queda patente en su amplio abanico de aplicaciones en diversos ámbitos científicos e industriales. Uno de los campos de aplicación más importantes es la electrosíntesis que aprovecha los procesos electroquímicos para sintetizar compuestos orgánicos e inorgánicos complejos. Este método es especialmente útil en la producción de productos farmacéuticos, agroquímicos y químicos especiales, ya que ofrece un control preciso de las condiciones de reacción y minimiza los residuos.
Los procesos de electrólisis son otra piedra angular de la electroquímica moderna, ya que desempeñan un papel crucial en la producción de productos químicos industriales esenciales como el cloro y el hidróxido de sodio en la industria cloroalcalina. Además, la electrólisis es vital en la extracción de metales como el aluminio y en la generación de hidrógeno mediante la electrólisis del agua, que es fundamental para las soluciones energéticas sostenibles.
La protección contra la corrosión es una aplicación crítica en la que se emplean principios electroquímicos para proteger los metales de la degradación. Técnicas como la galvanoplastia, la protección con ánodos de sacrificio y la protección anódica se utilizan ampliamente para prolongar la vida útil de las estructuras metálicas en diversos entornos, desde entornos marinos hasta instalaciones industriales.
La electrocatálisis representa un campo de vanguardia en el que la electroquímica se cruza con la catálisis para mejorar la eficacia de las reacciones químicas. Esto es especialmente importante en el desarrollo de pilas de combustible, que convierten la energía química directamente en energía eléctrica con gran eficacia y un impacto medioambiental mínimo.
En el ámbito de las nuevas fuentes de energía la electroquímica está a la vanguardia de la investigación en tecnologías avanzadas de baterías, incluidas las baterías de iones de litio y las baterías de estado sólido. Estas tecnologías son esenciales para la transición a los sistemas de energías renovables, ya que ofrecen mayores densidades de energía y una vida útil más larga que las baterías tradicionales.
Fotoelectroquímica fusiona la fotoquímica con la electroquímica, utilizando la energía luminosa para impulsar reacciones electroquímicas. Este campo es crucial para el desarrollo de células solares y la división fotoelectroquímica del agua, que puede convertir la luz solar directamente en hidrógeno, un combustible limpio y abundante.
Por último, la bioelectroquímica es una disciplina emergente que aplica los principios electroquímicos a los sistemas biológicos. Esto incluye el desarrollo de biosensores para el diagnóstico médico y la bioelectrocatálisis para la biorremediación y la producción de bioenergía. Estas aplicaciones ponen de relieve el profundo impacto de la electroquímica tanto en la salud humana como en la sostenibilidad medioambiental.
Aplicaciones prácticas de la electroquímica
Electrólisis y electrosíntesis
La electrólisis y la electrosíntesis son fundamentales para transformar materias primas en productos valiosos, impulsando varios procesos industriales. La industria cloroalcalina constituye una piedra angular, ya que utiliza la electrólisis para producir cloro e hidróxido de sodio, esenciales para diversos procesos químicos y sectores manufactureros. Este proceso no sólo garantiza un suministro constante de estos productos químicos, sino que también pone de relieve la eficacia y escalabilidad de los métodos electroquímicos.
En el ámbito de la electrólisis del aluminio el proceso Hall-Héroult sigue siendo indispensable. Este método, que consiste en la reducción electrolítica de alúmina disuelta en criolita fundida, es crucial para la industria mundial de producción de aluminio. El continuo perfeccionamiento y optimización de este proceso han reducido significativamente el consumo de energía y el impacto medioambiental, convirtiéndolo en un modelo de práctica industrial sostenible.

La electrólisis del agua ha sido objeto de gran atención, sobre todo en el contexto del almacenamiento de energías renovables y la producción de hidrógeno. Al dividir el agua en hidrógeno y oxígeno mediante una corriente eléctrica, este proceso ofrece una solución limpia y escalable para generar hidrógeno combustible, que puede almacenarse y utilizarse para alimentar diversas aplicaciones, desde el transporte hasta los procesos industriales.
La electrosíntesis amplía el alcance de las aplicaciones electroquímicas, permitiendo la síntesis de moléculas orgánicas complejas y productos farmacéuticos. Esta técnica permite un control preciso de las condiciones de reacción, lo que se traduce en un mayor rendimiento y pureza de los productos. La versatilidad de la electrosíntesis queda ejemplificada por su uso en la producción de productos químicos finos, agroquímicos y materiales especiales, lo que refuerza su importancia en la fabricación química moderna.
Estas aplicaciones ponen de manifiesto el potencial transformador de la electrólisis y la electrosíntesis, impulsando la innovación en múltiples industrias y contribuyendo a los objetivos de desarrollo sostenible.
Corrosión y protección de metales
La corrosión de los metales es un problema importante en diversas industrias, que provoca pérdidas económicas sustanciales y riesgos para la seguridad. Para mitigar estos efectos, se han desarrollado y aplicado varios métodos avanzados. Entre ellos la galvanoplastia es una técnica versátil que no sólo mejora el aspecto estético de los metales, sino también su resistencia a la corrosión. Al depositar una fina capa de un metal más resistente a la corrosión sobre la superficie del metal base, la galvanoplastia actúa como barrera protectora contra los elementos ambientales.
Otro método eficaz es protección con ánodos de sacrificio que consiste en fijar un metal más reactivo a la estructura que necesita protección. Este metal de sacrificio, a menudo de magnesio o zinc, se corroe preferentemente, protegiendo así de la corrosión al metal subyacente. Esta técnica se utiliza mucho en entornos marinos, donde los índices de corrosión son especialmente elevados.
La protección anódica es otro método sofisticado que consiste en polarizar un metal a un potencial en el que se vuelve pasivo, reduciendo significativamente su velocidad de corrosión. Este método es especialmente eficaz en metales que pueden formar una capa de óxido estable, como el acero inoxidable. Al controlar el potencial, la protección anódica puede prolongar la vida útil de infraestructuras críticas en industrias como la de procesamiento químico y refinado de petróleo.
Estos métodos, junto con otros como la protección catódica y tecnologías de revestimiento forman un sólido arsenal contra la corrosión de los metales que garantiza la longevidad y fiabilidad de las estructuras metálicas en diversas aplicaciones.
Bioelectroquímica
La bioelectroquímica representa una fascinante intersección de la biología y la electroquímica, con aplicaciones que abarcan desde el diagnóstico médico hasta la vigilancia del medio ambiente. Una de las aplicaciones más destacadas es el desarrollo de biosensores que aprovechan las moléculas biológicas para detectar y cuantificar sustancias específicas. Estos sensores son fundamentales en el diagnóstico médico, ya que permiten la detección rápida y precisa de biomarcadores, hormonas y agentes patógenos. Por ejemplo, los biosensores de glucosa se utilizan ampliamente en el control de la diabetes, ya que permiten monitorizar en tiempo real los niveles de glucosa en sangre.
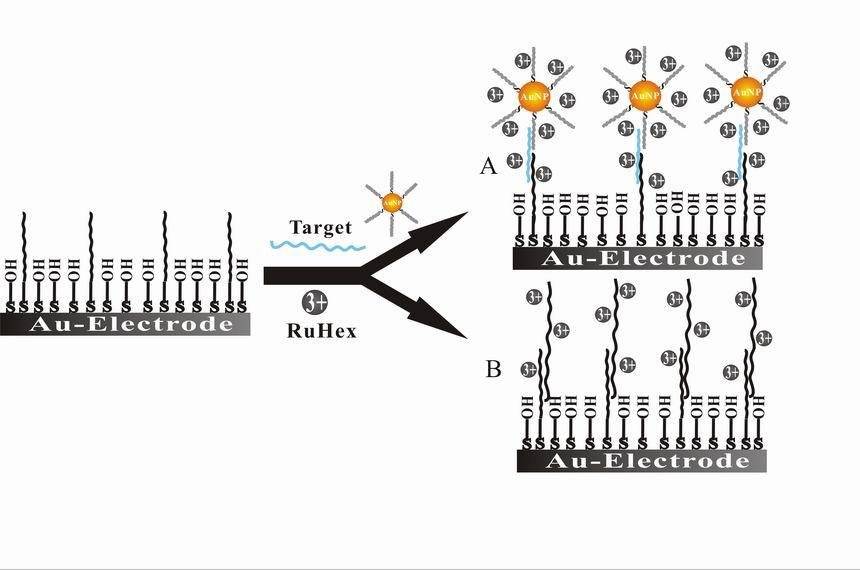
Además de los biosensores la bioelectrocatálisis es otro campo fundamental de la bioelectroquímica. Este campo se centra en el uso de enzimas o microorganismos como catalizadores en reacciones electroquímicas, mejorando la eficacia y especificidad de estos procesos. La bioelectrocatálisis tiene importantes implicaciones en las energías renovables, el tratamiento de residuos y los procesos industriales. Por ejemplo, las pilas de combustible microbianas utilizan la bioelectrocatálisis para convertir los residuos orgánicos directamente en electricidad, ofreciendo una solución sostenible para la producción de energía y la gestión de residuos.
| Aplicación | Descripción | Ejemplo |
|---|---|---|
| Biosensores | Utilizan moléculas biológicas para la detección y cuantificación | Biosensores de glucosa para el control de la diabetes |
| Bioelectrocatálisis | Utilización de enzimas o microorganismos como catalizadores en reacciones electroquímicas | Pilas de combustible microbianas para la producción de energía a partir de residuos orgánicos |
La sinergia entre principios biológicos y electroquímicos en bioelectroquímica sigue impulsando la innovación y promete nuevas herramientas y métodos tanto para la investigación científica como para aplicaciones prácticas.
Fuentes de alimentación químicas
Las fuentes de alimentación químicas abarcan una amplia gama de tecnologías, cada una con características y aplicaciones únicas. Las principales categorías son las pilas primarias, las pilas secundarias, las pilas de iones de litio y las pilas de combustible. Las pilas primarias, como las alcalinas y las de zinc-carbono, están diseñadas para un solo uso y suelen encontrarse en dispositivos cotidianos como mandos a distancia y linternas. Las baterías secundarias, o recargables, incluyen las de plomo-ácido y las de níquel-hidruro metálico, que pueden recargarse varias veces, lo que las hace ideales para aplicaciones que requieren energía sostenida durante periodos prolongados.
Las baterías de iones de litio han revolucionado la electrónica portátil y los vehículos eléctricos por su alta densidad energética, larga vida útil y bajo índice de autodescarga. Estas baterías se componen de compuestos de litio como electrodos y un electrolito no acuoso, lo que ofrece un equilibrio entre coste, rendimiento e impacto ambiental.
Las pilas de combustible, por su parte, representan un avance significativo en la tecnología de la energía sostenible. A diferencia de las baterías, que almacenan la energía químicamente, las pilas de combustible generan electricidad mediante la reacción electroquímica de un combustible, normalmente hidrógeno, con un oxidante, generalmente oxígeno. Este proceso tiene como resultado una alta eficiencia, baja contaminación y la capacidad de ajustar la generación de energía en función de la demanda. Las pilas de combustible son especialmente prometedoras para aplicaciones como los vehículos eléctricos, los sistemas de energía de reserva e incluso la exploración espacial, donde la energía fiable y limpia es primordial.
| Tipo de batería | Casos de uso principales | Principales ventajas |
|---|---|---|
| Baterías primarias | Dispositivos de un solo uso (mandos a distancia, linternas) | Económicas, ampliamente disponibles |
| Pilas secundarias | Dispositivos recargables (teléfonos, ordenadores portátiles) | Reutilizables, larga vida útil |
| Baterías de iones de litio | Electrónica portátil, vehículos eléctricos | Alta densidad energética, baja autodescarga |
| Pilas de combustible | Vehículos eléctricos, energía de reserva, espacio | Alta eficiencia, baja contaminación, escalable |
Productos relacionados
- Potencióstato de estación de trabajo electroquímico de laboratorio para uso en laboratorio
- Electrodo de Disco de Oro
- Electrodo de Hoja de Oro Electrodos de Oro para Electroquímica
- Soporte de electrodo para experimentos electroquímicos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
Artículos relacionados
- Guía completa de analizadores de suelos portátiles: Características, ventajas y aplicaciones
- Comprensión de los electrodos de referencia de calomelanos saturados: Composición, usos y consideraciones
- La Arquitectura de la Certeza: Dominando el Control en Celdas Electrolíticas Multifuncionales
- Revolucionando el control de calidad: La guía definitiva de los analizadores portátiles de baterías de litio
- Guía completa del electrodo de disco rotatorio (RDE) en estudios electroquímicos













