Para aplicaciones de laboratorio, el cuerpo de una célula de electrólisis se construye típicamente con vidrio de borosilicato de alta calidad, a menudo con un espesor de pared de alrededor de 4.5 a 5 mm. Este material se elige por su inercia química y resistencia térmica. Sin embargo, el contenedor físico es solo una parte de un sistema más grande diseñado para impulsar una reacción química utilizando electricidad.
El cuerpo de la célula es simplemente un contenedor inerte. La verdadera función de una célula electrolítica está definida por sus tres componentes internos principales: dos electrodos (ánodo y cátodo), un electrolito que contiene iones móviles y una fuente de alimentación externa para impulsar la reacción.

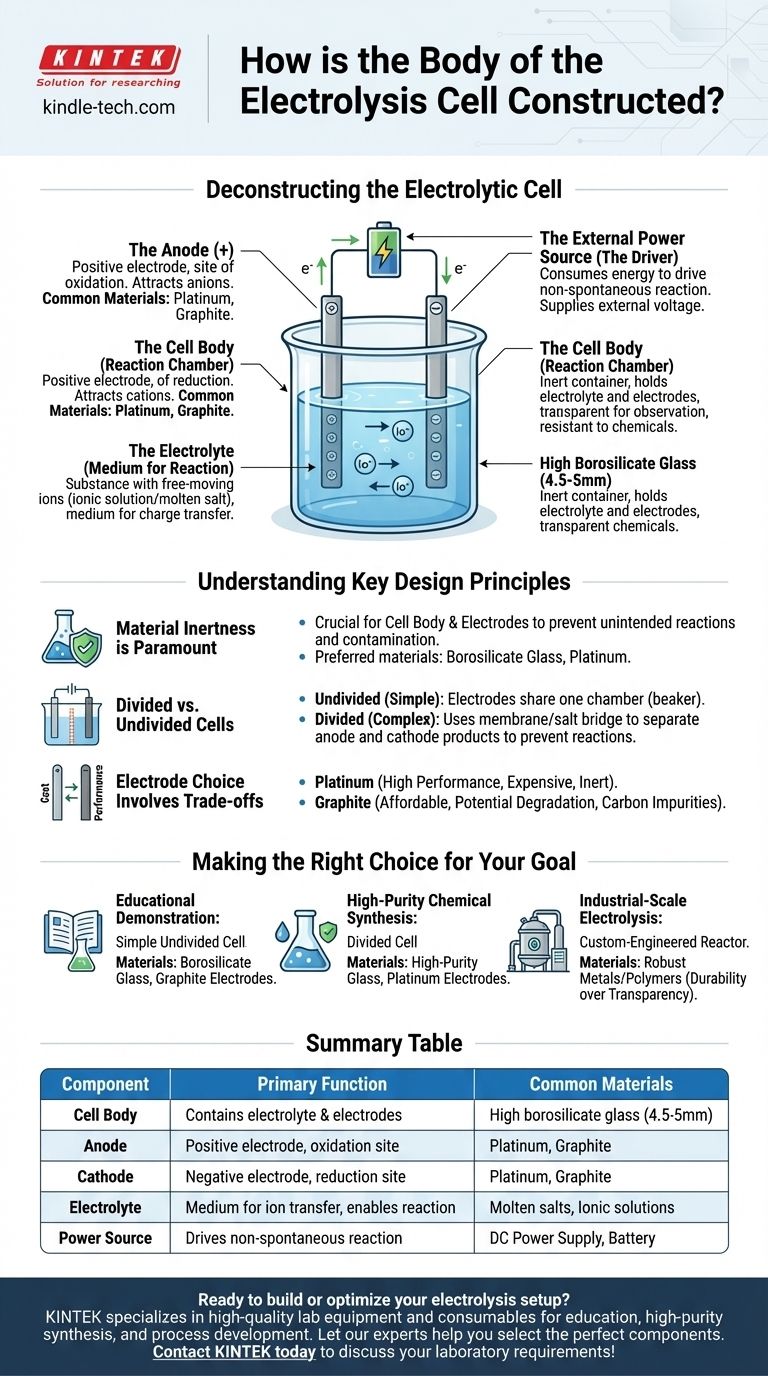
Deconstruyendo la Célula Electrolítica
Para comprender la construcción de la célula, debe mirar más allá del recipiente físico y analizar los componentes funcionales que alberga. Una célula electrolítica es un sistema completo donde cada parte desempeña un papel fundamental en el proceso de electrólisis.
El Cuerpo de la Célula (La Cámara de Reacción)
La función principal del cuerpo es contener el electrolito y mantener los electrodos en su lugar sin interferir con la reacción química.
El vidrio de borosilicato de alta calidad es un material común porque es transparente, lo que permite la observación, y altamente resistente a la corrosión de los productos químicos a menudo agresivos utilizados como electrolitos. Para aplicaciones específicas, se pueden utilizar otros materiales inertes como ciertos polímeros.
Los Electrodos (El Ánodo y el Cátodo)
Los electrodos son los conductores que introducen energía eléctrica en el sistema. Una célula electrolítica siempre tiene dos.
- El Ánodo es el electrodo positivo. Atrae iones cargados negativamente (aniones) y es donde ocurre la oxidación.
- El Cátodo es el electrodo negativo. Atrae iones cargados positivamente (cationes) y es donde ocurre la reducción.
Estos se fabrican típicamente con materiales inertes, como platino o grafito, que conducen bien la electricidad pero no participan fácilmente en la reacción química por sí mismos.
El Electrolito (El Medio para la Reacción)
El electrolito es la sustancia que contiene iones con movilidad y llena el cuerpo de la célula. Es el medio a través del cual se transfiere la carga entre los electrodos.
Los electrolitos pueden ser un compuesto iónico disuelto en un disolvente (como sal en agua) o un compuesto iónico fundido (como cloruro de sodio fundido). Los iones específicos dentro del electrolito son los que se oxidarán o reducirán durante la electrólisis.
La Fuente de Alimentación Externa (El Motor)
A diferencia de una batería que produce energía, una célula electrolítica consume energía para forzar que ocurra una reacción no espontánea.
Esta energía es suministrada por una fuente de alimentación externa, como una batería o una fuente de alimentación de CC, que se conecta al ánodo y al cátodo. Este voltaje externo es lo que empuja los electrones a través del circuito e impulsa los iones hacia sus respectivos electrodos.
Comprensión de los Principios Clave de Diseño
La construcción de una célula electrolítica se guía por principios fundamentales que aseguran su correcto funcionamiento. No comprenderlos puede llevar a experimentos fallidos o procesos ineficientes.
La Inercia del Material es Primordial
El principio más importante para el cuerpo de la célula y los electrodos es la inercia química. El contenedor y los conductores eléctricos no deben reaccionar con el electrolito. Cualquier reacción no deseada puede contaminar los productos e interrumpir el proceso electroquímico deseado. Esta es la razón por la cual se prefieren materiales especializados como el vidrio de borosilicato y el platino sobre el vidrio estándar o los metales reactivos.
Células Divididas vs. No Divididas
El diseño de célula más simple es una célula "no dividida", donde ambos electrodos comparten un electrolito común en una sola cámara, como un vaso de precipitados.
Sin embargo, a veces los productos formados en el ánodo y el cátodo pueden reaccionar entre sí. En estos casos, se utiliza una célula "dividida". Este diseño incorpora una membrana porosa o un puente salino para separar la célula en dos semiceldas distintas, manteniendo los productos aislados mientras se permite el flujo de iones entre los compartimentos.
La Elección del Electrodo Implica Compensaciones
Aunque ambos son comunes, la elección entre electrodos de platino y grafito implica una compensación clásica entre costo y rendimiento.
El platino es extremadamente inerte y eficiente, pero muy caro. El grafito es un conductor mucho más asequible, pero puede degradarse o reaccionar bajo ciertas condiciones, especialmente a voltajes altos o con electrolitos específicos, introduciendo potencialmente impurezas de carbono en el sistema.
Tomando la Decisión Correcta para su Objetivo
La construcción óptima de una célula electrolítica depende completamente de su aplicación prevista.
- Si su enfoque principal es la demostración educativa: Un vaso de precipitados simple y no dividido hecho de vidrio de borosilicato con electrodos de grafito económicos es perfectamente suficiente y rentable.
- Si su enfoque principal es la síntesis química de alta pureza: Una célula dividida hecha de vidrio de alta pureza con electrodos de platino estables e inertes es esencial para prevenir la contaminación del producto y las reacciones secundarias.
- Si su enfoque principal es la electrólisis a escala industrial: La célula será un reactor altamente especializado y diseñado a medida, a menudo construido con metales o polímeros robustos diseñados para durabilidad, eficiencia y operación continua en lugar de transparencia.
Comprender estos componentes centrales y sus funciones le permite seleccionar o diseñar una célula que se adapte con precisión a su objetivo.
Tabla de Resumen:
| Componente | Función Principal | Materiales Comunes |
|---|---|---|
| Cuerpo de la Célula | Contiene el electrolito y los electrodos | Vidrio de borosilicato de alta calidad (4.5-5mm) |
| Ánodo | Electrodo positivo; sitio de oxidación | Platino, Grafito |
| Cátodo | Electrodo negativo; sitio de reducción | Platino, Grafito |
| Electrolito | Medio para la transferencia de iones; permite la reacción | Sales fundidas, Soluciones iónicas |
| Fuente de Alimentación | Impulsa la reacción no espontánea | Fuente de alimentación de CC, Batería |
¿Listo para construir u optimizar su configuración de electrólisis? La construcción correcta de la célula es fundamental para el éxito de su laboratorio, ya sea para educación, síntesis de alta pureza o desarrollo de procesos. KINTEK se especializa en proporcionar el equipo de laboratorio y los consumibles de alta calidad que necesita, desde cristalería duradera de borosilicato hasta electrodos inertes de platino y grafito. Permita que nuestros expertos le ayuden a seleccionar los componentes perfectos para su aplicación específica. ¡Contacte a KINTEK hoy para discutir sus requisitos de laboratorio!
Guía Visual
Productos relacionados
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celdas personalizables de electrólisis PEM para diversas aplicaciones de investigación
- Celda Electrolítica Electroquímica de Baño de Agua de Doble Capa
La gente también pregunta
- ¿Cuál es la estructura general de la celda electrolítica óptica de doble capa tipo H con baño de agua? Diseño de precisión para experimentos controlados
- ¿Cuáles son los procedimientos después de usar una celda electrolítica de baño de agua de doble capa? Garantizar la longevidad del equipo y la precisión de los datos
- ¿Cuáles son las características clave de la celda electrolítica de baño de agua de cinco puertos? Control de precisión para experimentos electroquímicos
- ¿Cuáles son las características clave de una celda electrolítica de doble capa con baño de agua? Logre un control preciso de la temperatura para sus experimentos
- ¿Cuáles son los volúmenes típicos y las configuraciones de apertura para una celda electrolítica de baño de agua de doble capa? Optimice su configuración electroquímica



















