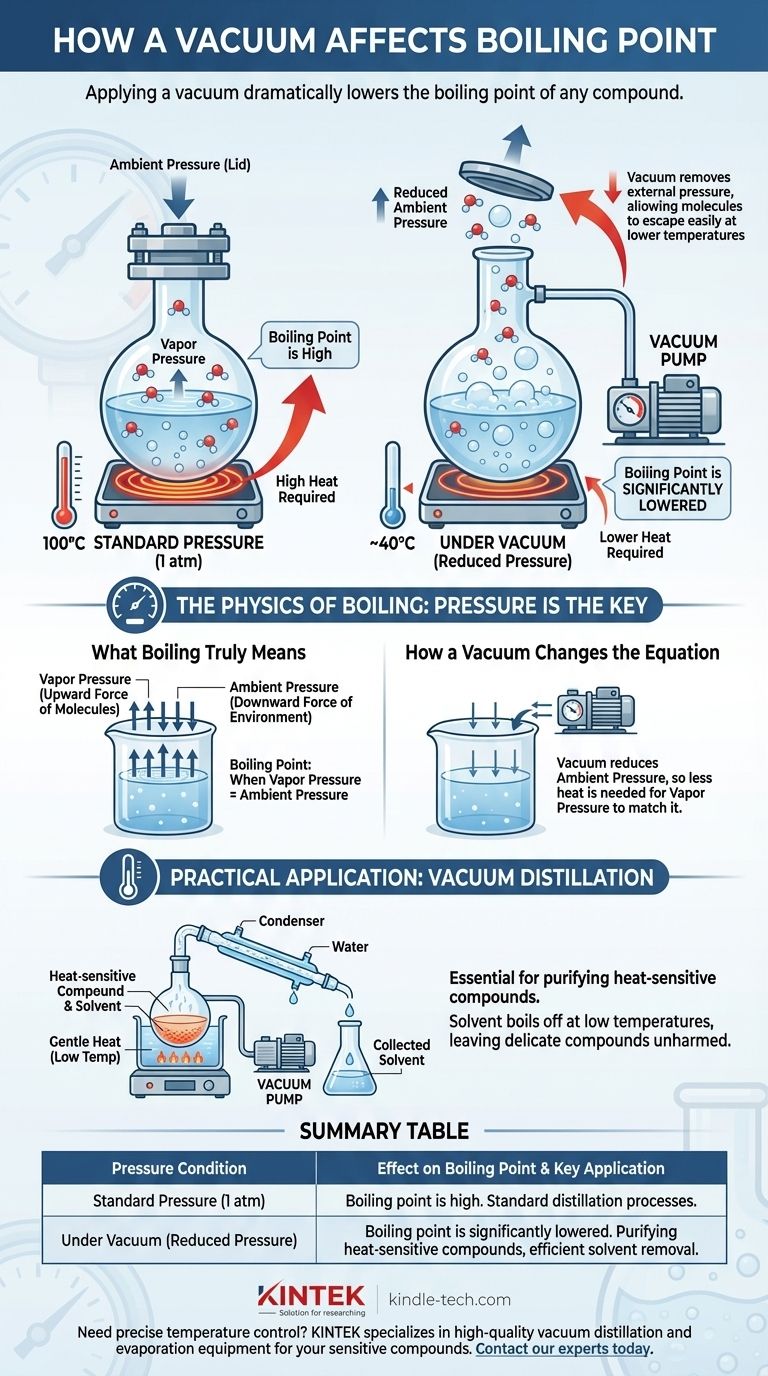
En resumen, aplicar un vacío reduce drásticamente el punto de ebullición de cualquier compuesto. La ebullición no es una temperatura fija, sino el punto en el que la presión de vapor interna de un líquido iguala la presión externa que presiona sobre su superficie. Al crear un vacío, se elimina esa presión externa, lo que facilita mucho que las moléculas escapen de la fase líquida y se conviertan en gas a una temperatura mucho más baja.
El punto de ebullición de un líquido no es una constante; es una función directa de la presión circundante. La reducción de esta presión con un vacío disminuye la energía necesaria para que las moléculas pasen a ser gas, haciendo que la sustancia hierva a una temperatura significativamente reducida.

La física de la ebullición: la presión es la clave
Para entender por qué un vacío tiene un efecto tan poderoso, primero debemos redefinir lo que realmente es "hervir". Se trata menos de una temperatura específica y más de una batalla de presiones.
Lo que realmente significa hervir
La ebullición es el estado físico específico en el que la presión de vapor de un líquido se iguala a la presión ambiente de su entorno.
En este punto de equilibrio, pueden formarse burbujas de vapor *dentro del volumen del líquido* y ascender a la superficie. Esto es fundamentalmente diferente de la simple evaporación, que solo ocurre en la superficie del líquido.
El papel de la presión de vapor
Cada líquido ejerce una cierta presión de vapor, que es la fuerza inherente de sus moléculas que intentan escapar a la fase gaseosa.
A medida que se calienta un líquido, sus moléculas ganan energía cinética. Este aumento de energía hace que presionen más contra su entorno, y por lo tanto, la presión de vapor aumenta con la temperatura.
Cómo actúa la presión ambiente como una "tapa"
La atmósfera que nos rodea ejerce una presión constante sobre todo, incluida la superficie de los líquidos. Se puede pensar en esta presión ambiente como una "tapa" física que mantiene las moléculas del líquido en su sitio.
Para que un líquido hierva, su presión de vapor debe ser lo suficientemente fuerte como para "quitar la tapa". A nivel del mar (1 atmósfera de presión), el agua debe alcanzar los 100 °C (212 °F) para generar suficiente presión de vapor para lograrlo.
Cómo un vacío cambia la ecuación
Una bomba de vacío funciona eliminando moléculas de gas de un sistema sellado, reduciendo así drásticamente la presión ambiente. Esto altera fundamentalmente las condiciones necesarias para la ebullición.
Retirar la "tapa"
Aplicar un vacío es el equivalente a levantar esa "tapa" de presión. Con menos moléculas de gas presionando sobre la superficie del líquido, las moléculas pueden escapar mucho más fácilmente.
Esta es la misma razón por la que el agua hierve a una temperatura más baja en altitudes elevadas. La presión atmosférica es menor en una montaña, por lo que se requiere menos calor para que la presión de vapor del agua la iguale.
El nuevo punto de ebullición más bajo
Debido a que la presión externa es ahora mucho menor, el líquido no necesita tanta energía térmica para aumentar su presión de vapor hasta el punto de ebullición.
El resultado es que la sustancia hervirá a una temperatura muy por debajo de su punto de ebullición estándar. Por ejemplo, bajo un vacío lo suficientemente fuerte, se puede hacer que el agua hierva a temperatura ambiente.
Aplicación práctica: Destilación al vacío
Este principio es esencial en química para purificar compuestos sensibles al calor. Un químico puede colocar una mezcla bajo vacío y calentarla suavemente.
Un disolvente volátil se evaporará a una temperatura muy baja, dejando atrás el compuesto deseado y más delicado, que nunca se expone a un calor alto potencialmente dañino.
Comprensión de las compensaciones y dificultades
Aunque es potente, el uso de un vacío para reducir el punto de ebullición no está exento de desafíos y requiere una consideración cuidadosa.
Riesgo de "bumping" (efervescencia violenta)
Bajo vacío, los líquidos pueden hervir explosivamente en un fenómeno llamado bumping. El calentamiento desigual puede hacer que una porción del líquido se sobrecaliente, convirtiéndose repentinamente en vapor con fuerza violenta. Esto se suele controlar utilizando piedras de ebullición o agitación constante.
Dificultad con sustancias de baja volatilidad
Para sustancias con fuerzas intermoleculares muy débiles y, por lo tanto, presiones de vapor muy bajas (como aceites o líquidos iónicos), incluso un vacío alto puede no reducir el punto de ebullición lo suficiente como para prevenir la descomposición térmica. Existe un límite práctico para la utilidad de la técnica.
Integridad del equipo y del sellado
Lograr y mantener un vacío profundo requiere bombas especializadas y cristalería o recipientes perfectamente sellados. Incluso una fuga menor puede comprometer la presión del sistema, haciendo que el punto de ebullición aumente inesperadamente.
Tomar la decisión correcta para su objetivo
Manipular la presión es una herramienta, y su aplicación depende totalmente de su objetivo.
- Si su enfoque principal es purificar un compuesto sensible al calor: Utilice la destilación al vacío para separar los componentes a temperaturas que eviten la descomposición o reacciones secundarias no deseadas.
- Si su enfoque principal es eliminar un disolvente de manera eficiente: Aplique un vacío, a menudo con rotación (como en un evaporador rotatorio), para evaporar rápidamente los disolventes sin necesidad de calor elevado.
- Si su enfoque principal es deshidratar un material delicado: Utilice un vacío profundo para reducir el punto de ebullición/sublimación del agua, permitiendo la deshidratación a bajas temperaturas (liofilización) que preserva la estructura del material.
En última instancia, comprender la relación entre presión y temperatura le proporciona un control preciso sobre el estado físico de una sustancia.
Tabla de resumen:
| Condición de presión | Efecto sobre el punto de ebullición | Aplicación clave |
|---|---|---|
| Presión estándar (1 atm) | El punto de ebullición está en su temperatura estándar y alta. | Procesos de destilación estándar. |
| Bajo vacío (Presión reducida) | El punto de ebullición se reduce significativamente. | Purificación de compuestos sensibles al calor, eliminación eficiente de disolventes. |
¿Necesita un control preciso de la temperatura para sus compuestos sensibles? KINTEK se especializa en equipos de evaporación y destilación al vacío de alta calidad, incluidos evaporadores rotatorios, diseñados para proteger sus materiales delicados al reducir los puntos de ebullición. Nuestro equipo de laboratorio garantiza un procesamiento eficiente y seguro para investigadores y profesionales de laboratorio. ¡Contacte con nuestros expertos hoy mismo para encontrar la solución de vacío perfecta para su aplicación!
Guía Visual
Productos relacionados
- Bomba de Vacío de Agua Circulante para Uso de Laboratorio e Industrial
- Bomba de vacío de paletas rotativas de laboratorio para uso en laboratorio
- Bomba de vacío de diafragma sin aceite para uso en laboratorio e industrial
- Prensa Térmica Hidráulica Eléctrica Calefactada al Vacío para Laboratorio
- Válvula de bola de vacío de acero inoxidable 304 316, válvula de parada para sistemas de alto vacío
La gente también pregunta
- ¿Cuál es la temperatura de un horno? Depende de su proceso y del tipo de horno
- ¿Cómo afecta el control preciso de la temperatura al rendimiento del aceite de pirólisis? Maximizar la eficiencia de conversión de plástico a combustible
- ¿Cuál es el papel del horno de secado por vacío industrial en la síntesis de Y3Si2C2? Previene la oxidación y garantiza la pureza
- ¿Cuál es el papel del vacío en los métodos de deposición? Domine la pureza y el control para películas delgadas superiores
- ¿Qué es el tratamiento térmico en materiales metálicos? Adapte las propiedades del metal para un rendimiento superior
- ¿Cuáles son las precauciones de seguridad durante el proceso de tratamiento térmico? Una guía para mitigar los peligros térmicos, atmosféricos y mecánicos
- ¿Cuáles son los principales inconvenientes del proceso de sinterización en fase líquida? Mitigar los riesgos para una mejor densificación
- ¿Cuáles son los cuatro tipos de procesos de tratamiento térmico? Recocido maestro, normalizado, temple y revenido



















