En cualquier sistema electroquímico, las dos precauciones más críticas son asegurar la polaridad correcta de los electrodos y seleccionar el electrolito adecuado para su reacción. La polaridad dicta qué proceso químico ocurre dónde, mientras que el electrolito proporciona el medio necesario para ese proceso. Un error en cualquiera de ellos puede llevar a experimentos fallidos, equipos dañados o riesgos de seguridad significativos.
La polaridad de sus electrodos define la dirección de la reacción química, y el electrolito determina su viabilidad. Un desajuste en cualquiera de ellos alterará, inhibirá o corromperá activamente el proceso electroquímico previsto.
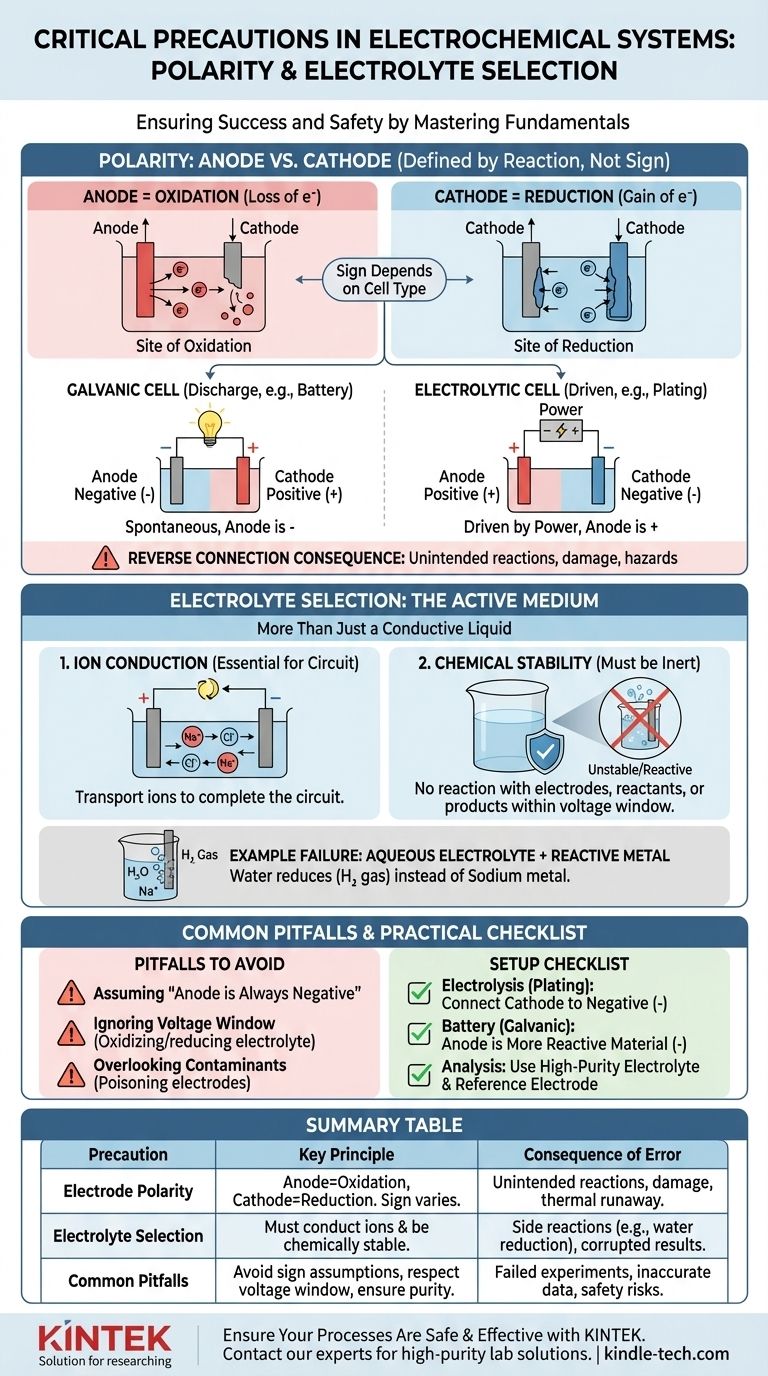
El papel crítico de la polaridad: Ánodo vs. Cátodo
Identificar correctamente su ánodo y cátodo es el primer paso para construir una celda electroquímica funcional y predecible. Esto va más allá de simplemente etiquetar los terminales como "positivo" o "negativo".
Lo que realmente significa "Polaridad"
Los términos ánodo y cátodo se definen por el tipo de reacción, no por su carga.
- El Ánodo es siempre el sitio de Oxidación (pérdida de electrones).
- El Cátodo es siempre el sitio de Reducción (ganancia de electrones).
La confusión surge porque el signo (+ o -) de estos electrodos depende del tipo de celda. En una batería descargándose (una celda galvánica), el ánodo es el terminal negativo. En una configuración de electrólisis (una celda electrolítica), el ánodo está conectado al terminal positivo de la fuente de alimentación.
La consecuencia de una conexión inversa
Conectar los electrodos incorrectamente fuerza a que las reacciones químicas se ejecuten en sentido inverso o de una manera no deseada.
En una celda electrolítica (por ejemplo, galvanoplastia), una conexión inversa significa que se arrancará material del electrodo que se pretendía recubrir y se depositará material en el ánodo de origen, destruyendo ambos.
En una batería recargable, cargar con polaridad invertida puede causar daños irreversibles a las estructuras de los electrodos, lo que lleva a una pérdida permanente de capacidad, cortocircuitos internos y un posible embalamiento térmico peligroso.
Selección del electrolito: Más que un simple líquido conductor
El electrolito no es un componente pasivo; es una parte activa y crítica del sistema electroquímico. Sus propiedades dictan qué reacciones son incluso posibles.
La función principal: Conducción iónica
El trabajo más básico del electrolito es transportar iones entre el ánodo y el cátodo, completando el circuito eléctrico. Sin un medio para el flujo de iones, toda la reacción se detendría instantáneamente.
La función crítica: Estabilidad química
El electrolito y su disolvente deben ser químicamente inertes bajo las condiciones de operación. No deben reaccionar con los electrodos, los reactivos o los productos de su reacción principal. Esta es la fuente de las "reacciones secundarias no deseadas" mencionadas en los protocolos de seguridad.
Ejemplo: Por qué los electrolitos acuosos fallan para metales reactivos
Imagine intentar producir sodio metálico mediante la electrólisis de una solución de cloruro de sodio (NaCl) en agua.
Podría esperar que los iones de sodio (Na+) se muevan al cátodo, ganen un electrón y formen sodio metálico. Sin embargo, el agua (H₂O) también está presente y es mucho más fácil de reducir que los iones de sodio. Como resultado, producirá gas hidrógeno en el cátodo y no se formará sodio metálico. La elección del electrolito hizo imposible la reacción deseada.
Comprensión de las compensaciones y los errores comunes
Evitar errores simples requiere comprender los principios subyacentes que rigen todas las celdas electroquímicas.
Error común 1: Asumir que "el ánodo es negativo"
El error más común es identificar erróneamente el ánodo y el cátodo. Recuerde siempre definirlos por la reacción (oxidación/reducción), no por un signo fijo. Determine si su celda es galvánica (espontánea) o electrolítica (impulsada por energía externa) para asignar el signo correcto.
Error común 2: Ignorar la ventana de voltaje del electrolito
Cada electrolito tiene una ventana de potencial de estabilidad. Si aplica un voltaje que excede esta ventana, comenzará a oxidar o reducir el electrolito mismo, no su objetivo previsto. Esto consume energía, crea impurezas y detiene la reacción deseada.
Error común 3: Pasar por alto los contaminantes
Incluso las impurezas traza en un electrolito pueden tener un impacto masivo. Los contaminantes pueden depositarse en la superficie de un electrodo, "envenenándolo" e impidiendo la reacción deseada, o pueden actuar como catalizadores para reacciones secundarias no deseadas que corrompen sus resultados.
Una lista de verificación práctica para su configuración
Utilice estas pautas para asegurarse de que su configuración experimental sea correcta desde el principio.
- Si su enfoque principal es la electrólisis (por ejemplo, recubrimiento, refinación): Conecte el electrodo que desea recubrir (el cátodo) al terminal negativo de la fuente de alimentación y el material de origen (el ánodo) al terminal positivo.
- Si su enfoque principal es construir una batería (una celda galvánica): El material más reactivo químicamente que se oxida es su ánodo (terminal negativo), y el material menos reactivo es su cátodo (terminal positivo).
- Si su enfoque principal es el análisis electroquímico preciso: Utilice un electrolito de alta pureza, a menudo desgasificado, para evitar reacciones secundarias, y confirme la configuración de su polaridad en relación con un estándar o electrodo de referencia conocido.
Al tratar la polaridad y la elección del electrolito como parámetros de diseño fundamentales, pasará de simplemente seguir instrucciones a realmente diseñar el resultado electroquímico deseado.

Tabla resumen:
| Precaución | Principio clave | Consecuencia del error |
|---|---|---|
| Polaridad del electrodo | Ánodo = sitio de oxidación; Cátodo = sitio de reducción. El signo depende del tipo de celda (galvánica vs. electrolítica). | La conexión inversa provoca reacciones no deseadas (por ejemplo, decapado en lugar de recubrimiento), daños en el equipo o embalamiento térmico. |
| Selección del electrolito | Debe conducir iones y permanecer químicamente estable bajo las condiciones de operación (ventana de voltaje). | Un electrolito incorrecto permite reacciones secundarias (por ejemplo, reducción de agua en lugar de deposición de sodio), corrompe los resultados y desperdicia energía. |
| Errores comunes | Asumir que 'el ánodo es siempre negativo'; ignorar la ventana de voltaje del electrolito; pasar por alto los contaminantes. | Experimentos fallidos, datos inexactos y riesgos de seguridad debido a procesos químicos no deseados. |
Asegure que sus procesos electroquímicos sean seguros y efectivos con KINTEK
¿Está configurando un proyecto de electrólisis, recubrimiento o desarrollo de baterías? La polaridad adecuada de los electrodos y la selección del electrolito son innegociables para lograr resultados precisos y mantener la seguridad. En KINTEK, nos especializamos en proporcionar equipos y consumibles de laboratorio de alta pureza, incluyendo celdas electroquímicas, electrolitos puros y fuentes de alimentación confiables, para satisfacer las necesidades únicas de su laboratorio.
Permítanos ayudarle a evitar errores y peligros costosos. Contacte a nuestros expertos hoy para discutir su aplicación específica y descubrir cómo las soluciones de KINTEK pueden mejorar su flujo de trabajo electroquímico.
Guía Visual
Productos relacionados
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo de Disco de Oro
- Electrodo de Referencia de Sulfato de Cobre para Uso en Laboratorio
- Electrodo Auxiliar de Platino para Uso en Laboratorio
- Pestañas de níquel y aluminio para baterías de litio de paquete blando
La gente también pregunta
- ¿Cuál es el papel común de un electrodo de disco de platino? Una guía para su uso principal como electrodo de trabajo
- ¿Cuáles son las especificaciones de los electrodos funcionales de platino-titanio? Maximizar el rendimiento electroquímico
- ¿Qué es el RRDE en electroquímica? Desbloquee vías de reacción detalladas con análisis de doble electrodo
- ¿Cómo se debe limpiar un electrodo de hilo/varilla de platino antes de usarlo? Una guía para datos electroquímicos fiables
- ¿Cuál es una aplicación común para el electrodo de alambre/varilla de platino? La guía esencial de los contraelectrodos



















