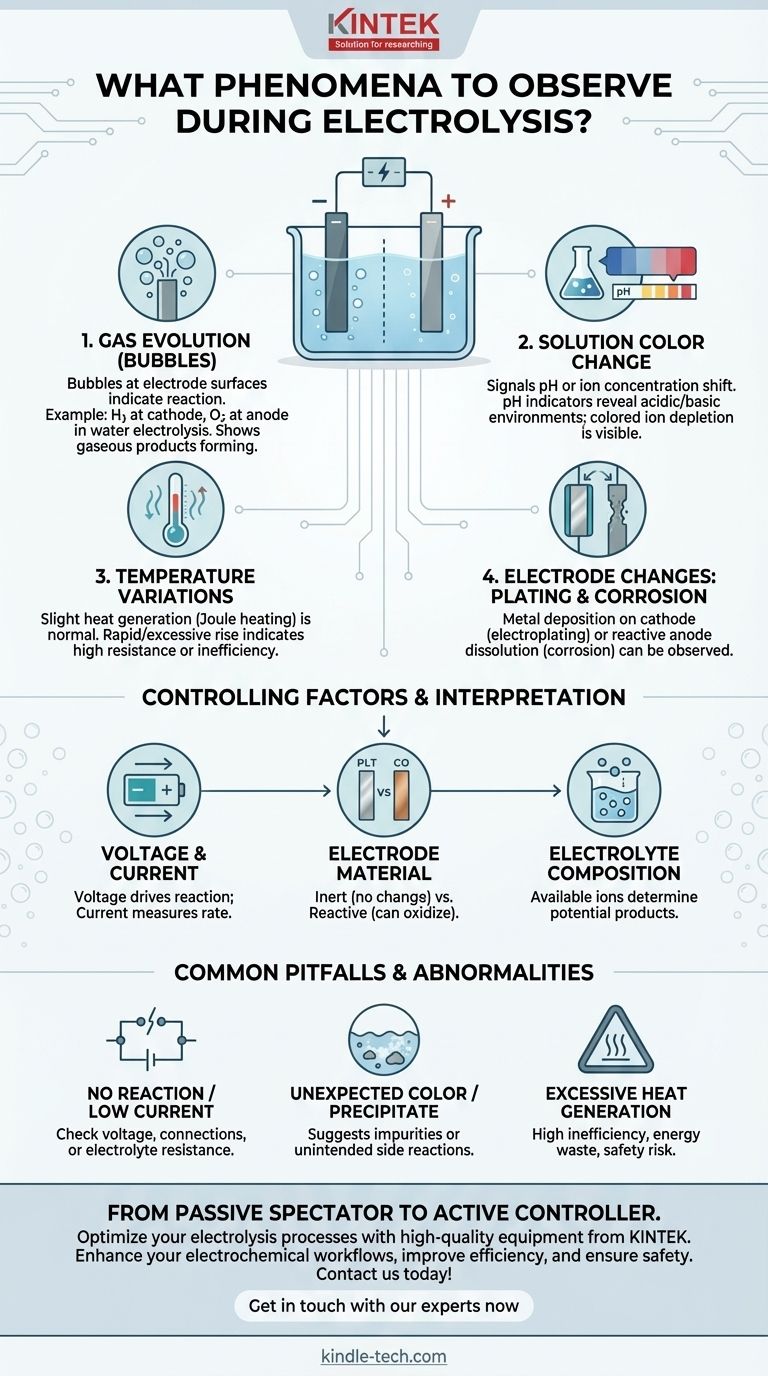
Al realizar la electrólisis, los fenómenos principales a observar son la generación de burbujas de gas en las superficies de los electrodos, los cambios en el color de la solución y cualquier variación de temperatura. Estas señales visuales y físicas son indicadores directos de la reacción electroquímica subyacente, proporcionando una retroalimentación inmediata sobre si el proceso se está desarrollando como se espera.
Observar la electrólisis es más que simplemente ver cómo se forman burbujas. Cada fenómeno es una pieza de datos que revela la identidad, eficiencia y seguridad de la reacción, permitiéndole interpretar lo que está sucediendo a nivel molecular.

Interpretación de Observaciones Clave
Cada evento observable durante la electrólisis proporciona una pista sobre las transformaciones químicas que tienen lugar. Comprender lo que significan estas pistas es esencial para controlar el resultado.
Evolución de Gas (Burbujas) en los Electrodos
Las burbujas son la señal más común e inmediata de que está ocurriendo una reacción. Estos son productos gaseosos que se forman directamente en las superficies de los electrodos.
Por ejemplo, en la electrólisis del agua, verá gas hidrógeno burbujeando en el electrodo negativo (cátodo) y gas oxígeno en el electrodo positivo (ánodo). El gas específico producido depende completamente de la composición del electrolito.
Cambios en el Color de la Solución
Un cambio de color en el electrolito puede indicar varios eventos diferentes. A menudo indica un cambio en el pH o un cambio en la concentración de iones específicos.
Si hay presente un indicador de pH (como el tornasol o el indicador universal), los cambios de color cerca de los electrodos revelan la formación de ambientes ácidos o básicos. Alternativamente, si el electrolito contiene iones coloreados (como los iones de cobre(II) azules), su agotamiento o formación se puede rastrear visualmente.
Variaciones de Temperatura
La electrólisis implica el paso de una corriente eléctrica a través de una solución, lo que inherentemente genera algo de calor debido a la resistencia eléctrica (calentamiento Joule).
Un ligero y gradual aumento de la temperatura es normal. Sin embargo, un aumento rápido o excesivo de la temperatura puede indicar una alta resistencia interna, un proceso ineficiente o una reacción secundaria no deseada y altamente exotérmica.
Cambios en los Electrodos: Recubrimiento o Corrosión
Los propios electrodos pueden cambiar. En procesos como la galvanoplastia, observará una capa de metal depositándose y creciendo en el cátodo.
Por el contrario, si se utiliza un ánodo reactivo (como cobre o zinc), es posible que lo vea corroerse o disolverse visiblemente en la solución a medida que se oxida. Los electrodos inertes, como el platino o el carbono, no deberían mostrar ningún cambio.
Comprensión de los Factores de Control
Los fenómenos que observa están directamente controlados por los parámetros que establece. El tipo de electrodo y electrolito determinan qué puede suceder, mientras que el voltaje y la corriente determinan si sucede y con qué rapidez.
Voltaje y Corriente
El voltaje es la fuerza impulsora de la reacción; se debe aplicar un voltaje mínimo (el potencial de descomposición) para que comience la electrólisis.
La corriente es una medida de la velocidad de la reacción. Es directamente proporcional a la velocidad a la que se transfieren los electrones y, por lo tanto, a la velocidad a la que se forman los productos.
Material del Electrodo (Inerte vs. Reactivo)
Los electrodos inertes (por ejemplo, platino, grafito) sirven solo como superficie para que la reacción ocurra sin participar químicamente.
Los electrodos reactivos (por ejemplo, cobre, zinc, níquel) pueden oxidarse en el ánodo, entrando en la solución como iones. Este es un principio fundamental en la electrorrefinación y la galvanoplastia.
Composición del Electrolito
Los iones disponibles en el electrolito determinan los productos potenciales. En una solución con múltiples tipos de iones, el que sea más fácil de reducir reaccionará en el cátodo, y el que sea más fácil de oxidar reaccionará en el ánodo.
Errores Comunes y Situaciones Anormales
Observar el proceso le permite identificar cuándo las cosas no funcionan correctamente. Estas "situaciones anormales" son herramientas de diagnóstico críticas.
Sin Reacción o Corriente Muy Baja
Esto suele indicar un problema con la configuración. La causa podría ser un voltaje insuficiente, una mala conexión eléctrica o un electrolito con muy alta resistencia.
Color o Precipitado Inesperado
Si observa un color no predicho por la reacción principal o ve un sólido (precipitado) formándose en la solución, sugiere fuertemente la presencia de impurezas. Esto indica que está ocurriendo una reacción secundaria no deseada.
Generación Excesiva de Calor
Como se mencionó, un calor significativo apunta a una alta ineficiencia. Significa que una gran parte de la energía eléctrica se está desperdiciando como calor en lugar de usarse para impulsar el cambio químico deseado. Esto también puede representar un riesgo para la seguridad.
Tomando la Decisión Correcta para Su Objetivo
Su interpretación de estas observaciones depende del objetivo de su experimento.
- Si su enfoque principal es demostrar un principio básico (por ejemplo, electrólisis del agua): Busque las señales clásicas de burbujeo de gas en ambos electrodos y use un indicador de pH para ver la formación de base en el cátodo y ácido en el ánodo.
- Si su enfoque principal es la galvanoplastia: La observación más importante es la deposición uniforme de metal en el cátodo, siendo la corriente y el tiempo los parámetros clave de control.
- Si su enfoque principal es el análisis cuantitativo (por ejemplo, verificar las Leyes de Faraday): Debe asegurar una corriente constante y estable, ya que esto relaciona directamente la cantidad de producto formado con la carga total que pasa a través de la celda.
Al observar cuidadosamente estos fenómenos, usted pasa de ser un espectador pasivo a un controlador activo del proceso electroquímico.
Tabla Resumen:
| Fenómeno | Lo que Indica | Conocimiento Clave |
|---|---|---|
| Burbujas de Gas | Reacción en curso; formación de producto (por ejemplo, H₂ en el cátodo, O₂ en el ánodo en agua) | Identifica los productos gaseosos de la reacción |
| Cambio de Color | Cambio de pH o de concentración iónica (por ejemplo, con indicadores o iones coloreados como Cu²⁺) | Revela el ambiente químico y el progreso de la reacción |
| Aumento de Temperatura | Calentamiento Joule; el calor excesivo puede indicar ineficiencia o reacciones secundarias | Monitorea la seguridad del proceso y la eficiencia energética |
| Recubrimiento/Corrosión del Electrodo | Deposición de metal (cátodo) o disolución (ánodo) en procesos como la galvanoplastia | Crítico para aplicaciones que requieren modificación de la superficie |
Optimice Sus Procesos de Electrólisis con KINTEK
¿Está buscando lograr un control preciso sobre sus experimentos de electrólisis o aplicaciones industriales? Comprender estos fenómenos observables es solo el primer paso. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluidos electrodos confiables, fuentes de alimentación estables y celdas de electrólisis duraderas diseñadas para un rendimiento constante y resultados precisos.
Ya sea que esté realizando investigaciones, desarrollando nuevos materiales o ampliando la producción, nuestros productos lo ayudan a monitorear y controlar los parámetros clave de manera efectiva. Contáctenos hoy para discutir cómo nuestras soluciones pueden mejorar sus flujos de trabajo electroquímicos, mejorar la eficiencia y garantizar la seguridad.
Póngase en contacto con nuestros expertos ahora para encontrar el equipo perfecto para las necesidades de su laboratorio.
Guía Visual
Productos relacionados
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda Electrolítica Electroquímica de Baño de Agua de Doble Capa
- Celda electroquímica de baño de agua óptico electrolítico
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
La gente también pregunta
- ¿Cuál es el procedimiento adecuado para la limpieza posterior al experimento y el almacenamiento de una celda electrolítica totalmente de cuarzo? Garantizar la longevidad y la reproducibilidad
- ¿Cuáles son los pasos necesarios para preparar una celda electrolítica totalmente de cuarzo antes de un experimento? Garantice la precisión y la seguridad
- ¿Qué precauciones se deben tomar al manipular y usar una celda electrolítica de cuarzo puro? Garantice un rendimiento seguro, preciso y duradero
- ¿Cuáles son los procedimientos operativos y las precauciones de seguridad durante un experimento que utiliza una celda electrolítica totalmente de cuarzo? Garantice la seguridad y la precisión en su laboratorio
- ¿Cuáles son las especificaciones estándar de apertura para las celdas electrolíticas de cuarzo totalmente selladas y no selladas? Optimice su configuración electroquímica



















