Introducción al electrodo de glicercurio
Definición y composición
El electrodo de glicmercurio es un dispositivo especializado que consiste en una solución de mercurio metálico, junto con sus sales insolubles, Hg₂Cl₂ (calomelano) y KCl (cloruro potásico). La composición de este electrodo es crucial, ya que influye directamente en sus características operativas. El potencial de electrodo del electrodo de glicercurio es muy sensible a la concentración de iones cloruro, una propiedad muy utilizada en química analítica. Esta sensibilidad se cuantifica y tabula, permitiendo mediciones precisas en diversas configuraciones experimentales.
Una de las características notables del electrodo de glicercurio es su mínimo coeficiente de temperatura del potencial eléctrico. Esta característica es especialmente ventajosa cuando el electrodo se sumerge en una solución de cloruro potásico con una concentración de 0,1 mol-dm³. En tales condiciones, la variación del potencial eléctrico con los cambios de temperatura es despreciable, lo que garantiza mediciones estables y fiables. Esta estabilidad es una razón clave por la que se prefiere el electrodo de glicercurio en muchas aplicaciones analíticas, especialmente cuando son esenciales lecturas precisas y consistentes.
Preparación y uso como puente salino
El electrodo de glicercurio, cuando se satura con cloruro potásico, ofrece un proceso de preparación sencillo y sirve como puente salino eficaz durante su funcionamiento. Esta facilidad de preparación y funcionalidad lo convierten en una opción favorecida en diversas aplicaciones de química analítica.
Para preparar el electrodo de glicercurio como puente salino, se combina una solución de mercurio metálico con sus sales insolubles, concretamente Hg₂Cl₂ y KCl. La concentración de iones cloruro en la solución influye directamente en el potencial del electrodo, que es un factor crítico para su rendimiento. Cabe destacar que el coeficiente de temperatura del potencial eléctrico sigue siendo pequeño, sobre todo cuando la solución de cloruro potásico se mantiene a una concentración de 0,1 mol-dm.
En la práctica, el electrodo de glicercurio actúa como un conducto, facilitando el movimiento de iones entre dos soluciones sin permitir la mezcla directa. Esta capacidad es crucial para mantener la integridad del entorno químico en cada solución, garantizando así mediciones precisas y fiables en los métodos potenciométricos.
El papel del electrodo de glicercurio como puente salino se ve reforzado por su compatibilidad con otros electrodos, como el electrodo de calomelano, que sirve de referencia estable. Este emparejamiento permite la determinación precisa de los potenciales de electrodo, solidificando el estatus del electrodo de glicercurio como electrodo estándar secundario.

Información básica
Nombre en chino
El electrodo de glicercurio, conocido en chino como 甘汞电极 (Gān gǒng diàn jí), es una herramienta especializada en química analítica. Este electrodo está compuesto por mercurio metálico, sus sales insolubles Hg₂Cl₂, y una solución de cloruro potásico (KCl). El potencial del electrodo es sensible a la concentración de iones cloruro, lo que lo convierte en un componente valioso en diversos procedimientos analíticos. En particular, el coeficiente de temperatura de su potencial eléctrico es mínimo, sobre todo cuando se utiliza con una solución de cloruro potásico de 0,1 mol-dm, lo que garantiza la estabilidad y la reproducibilidad de las mediciones.
En el contexto de la nomenclatura científica china, el término 甘汞 (Gān gǒng) se traduce directamente como "mercurio dulce" o "glicimercurio", lo que refleja la composición primaria del electrodo. Esta denominación destaca las propiedades únicas del electrodo y su papel en la química analítica, donde sirve tanto de indicador como de electrodo de referencia en los métodos potenciométricos. Su nombre chino no sólo significa su composición química, sino que también subraya su importancia en el campo, donde a menudo se prefiere por su facilidad de preparación y su uso como puente salino.
Temperatura aplicable
El electrodo de glicercurio está diseñado para funcionar de forma óptima dentro de un rango de temperatura específico, concretamente por debajo de 70°C . El funcionamiento del electrodo por encima de este umbral puede provocar inestabilidad en su valor potencial, haciéndolo menos fiable para mediciones precisas en química analítica. Esta limitación de temperatura es crucial para mantener el rendimiento y la longevidad del electrodo, garantizando que siga siendo una opción viable para diversas aplicaciones.
Para entender por qué existe esta limitación de temperatura, es importante considerar los componentes del electrodo de glicercurio, en particular el Hg₂Cl₂ (calomelano) y KCl (cloruro potásico) (cloruro potásico). Por encima de 70 °C, la actividad térmica puede alterar el equilibrio de estas soluciones, lo que provoca fluctuaciones en el potencial del electrodo. Esta inestabilidad puede comprometer la precisión de las mediciones, especialmente en procedimientos analíticos sensibles.
| Rango de temperatura | Estabilidad del electrodo |
|---|---|
| Por debajo de 70°C | Estable y fiable |
| Por encima de 70°C | Inestable y poco fiable |
Mantener el electrodo dentro de su rango de temperatura recomendado es esencial para preservar su integridad y asegurar resultados consistentes. Esta precaución garantiza que el electrodo de glicercurio siga siendo una herramienta fiable en química analítica, especialmente en aplicaciones que requieren mediciones precisas y reproducibles.
Potencial del electrodo
El electrodo de glicercurio presenta un potencial de electrodo estable y bien documentado, que es crucial para su uso en química analítica. En concreto, este electrodo mantiene un potencial de +0,2415 V en condiciones estándar, lo que lo convierte en una referencia fiable en diversas mediciones electroquímicas.
Este valor de potencial específico es especialmente significativo cuando el electrodo se utiliza junto con el electrodo de hidrógeno estándar (SHE). Comparando el potencial del electrodo de glicercurio con el del SHE, los investigadores pueden determinar con precisión el potencial relativo del electrodo de otros sistemas. Este proceso es esencial para calibrar y normalizar las mediciones electroquímicas, garantizando la precisión y reproducibilidad de los resultados experimentales.
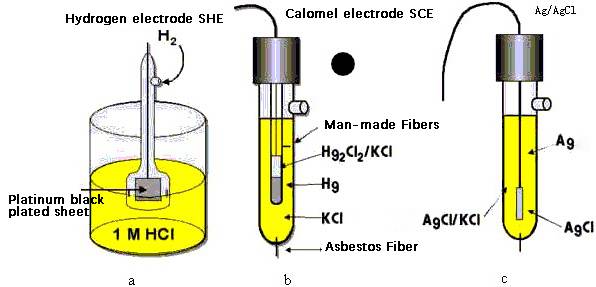
Además, se sabe que el potencial del electrodo de glicercurio es relativamente insensible a los cambios de temperatura, especialmente cuando se sumerge en una solución de cloruro potásico de 0,1 mol-dm. Esta característica mejora aún más su utilidad como electrodo de referencia, ya que minimiza las fluctuaciones de potencial debidas a variaciones ambientales.
En resumen, el potencial estable de +0,2415 V del electrodo de glicercurio, combinado con su bajo coeficiente de temperatura, lo convierte en una herramienta inestimable en el campo de la química analítica, especialmente en mediciones potenciométricas y como electrodo patrón secundario.
Características
Una de las características más destacadas del electrodo de glicercurio es su pequeño coeficiente de temperatura del potencial eléctrico . Esta característica es especialmente ventajosa en química analítica, donde la precisión y la estabilidad son primordiales. El coeficiente de temperatura se refiere al cambio en el potencial del electrodo con respecto a las variaciones de temperatura. En el caso del electrodo de glicercurio, este coeficiente sigue siendo mínimo, especialmente cuando el electrodo se sumerge en una solución de cloruro potásico con una concentración de 0,1 mol-dm. Esta estabilidad garantiza que el potencial del electrodo permanezca relativamente constante incluso en condiciones de temperatura fluctuante, lo que lo hace muy fiable para su uso en diversos procedimientos analíticos.
El pequeño coeficiente de temperatura es un resultado directo de la composición del electrodo, que incluye mercurio metálico, Hg₂Cl₂ y solución de KCl. La interacción entre estos componentes ayuda a mantener un potencial constante, que es crucial para obtener mediciones precisas en los métodos potenciométricos. Esta característica no sólo mejora la reproducibilidad del electrodo, sino que también amplía su aplicabilidad a través de diferentes configuraciones experimentales, donde el control de la temperatura podría no mantenerse perfectamente.
En resumen, el pequeño coeficiente de temperatura del potencial eléctrico del electrodo de glicercurio es una característica clave que subraya su idoneidad para el uso como electrodo de referencia en química analítica, donde la consistencia y la fiabilidad son esenciales.
Componentes
El electrodo de glicercurio está formado por tres componentes principales: mercurio metálico (Hg), cloruro mercurioso (Hg₂Cl₂) y una solución de cloruro potásico (KCl). Cada uno de estos componentes desempeña un papel crucial en el funcionamiento y la estabilidad del electrodo.
-
Mercurio metálico (Hg): Forma el núcleo del electrodo y es esencial para establecer la interfaz electroquímica. Su alta densidad y bajo punto de fusión lo hacen adecuado para mantener un potencial de electrodo estable.
-
Cloruro mercurioso (Hg₂Cl₂): También conocido como calomelano, este compuesto es insoluble en agua y actúa como tampón para estabilizar el potencial del electrodo. Garantiza que el electrodo mantenga una respuesta constante a los cambios en la concentración de iones cloruro.
-
Solución de cloruro de potasio (KCl): Esta solución tiene múltiples funciones. En primer lugar, proporciona los iones cloruro necesarios para interactuar con el cloruro mercurioso. En segundo lugar, ayuda en la preparación del electrodo facilitando la disolución de otros componentes. La concentración de KCl suele oscilar entre 0,1 mol-dm y soluciones saturadas, siendo esta última la más utilizada debido a su facilidad de preparación y estabilidad.
La combinación de estos componentes da como resultado un electrodo con un pequeño coeficiente de temperatura del potencial eléctrico, lo que lo hace muy fiable para su uso en química analítica, especialmente en métodos potenciométricos.

Campos de aplicación
El electrodo de glicercurio encuentra su principal aplicación en el ámbito de la química analítica . Este electrodo especializado es una herramienta fundamental en diversas técnicas analíticas, especialmente en métodos potenciométricos . En estos métodos, el electrodo de glicercurio funciona a menudo como un electrodo indicador Su potencial varía en respuesta a los cambios en la concentración de iones específicos en la solución analizada.
Una de las principales ventajas del electrodo de glicercurio en química analítica es su estabilidad y reproducibilidad . Estas cualidades lo convierten en un candidato ideal para su uso junto con un electrodo de referencia como el electrodo de calomelano. Juntos forman una célula electroquímica fiable que permite realizar mediciones precisas de los potenciales de electrodo. Esta configuración es crucial para aplicaciones que van desde las mediciones de pH hasta la determinación de diversas concentraciones de iones.
Además, la capacidad del electrodo de glicercurio para actuar como un electrodo estándar secundario subraya aún más su importancia en la química analítica. Al emparejarlo con el electrodo estándar de hidrógeno, los investigadores pueden calibrar y determinar con precisión el potencial de electrodo del electrodo de glicercurio, garantizando la precisión y fiabilidad de sus mediciones analíticas.
En resumen, el papel del electrodo de glicercurio en la química analítica es polifacético y abarca su uso como electrodo indicador, su estabilidad en las mediciones potenciométricas y sus capacidades de calibración como electrodo estándar secundario. Estas aplicaciones ponen de relieve su carácter indispensable en el campo de la química analítica.
Contenido básico en química analítica
Electrodos indicadores y de referencia
En los métodos potenciométricos, el electrodo de glicercurio funciona como electrodo indicador, mientras que el electrodo de calomelano actúa como electrodo de referencia estable. El electrodo de calomelano se construye a partir de mercurio metálico, calomelano (Hg₂Cl₂) y cloruro potásico (KCl). Esta configuración garantiza que el electrodo de calomel mantiene un potencial de electrodo estable y conocido, crucial para mediciones potenciométricas precisas.
Para conseguir esta estabilidad, el electrodo de calomelano emplea un sistema redox con concentraciones constantes de sus componentes, creando de hecho un sistema tamponado.Esta característica hace del electrodo de calomelano un electrodo de referencia (ER) ideal en el análisis potenciométrico.A diferencia del electrodo indicador, que responde de forma variable a los cambios en el analito, el electrodo de referencia se mantiene firme con una respuesta fija, proporcionando una línea de base fiable para las mediciones de potencial.
La distinción entre electrodos indicadores y de referencia es fundamental en las valoraciones potenciométricas.Los electrodos indicadores, como el electrodo de glicercurio, cambian su potencial en respuesta al analito, reflejando la concentración de la sustancia que se está midiendo.Por el contrario, los electrodos de referencia, como el electrodo de calomelano, mantienen un potencial constante, garantizando que cualquier cambio observado en el potencial se deba al analito y no al propio sistema de medición.
Existen varios tipos de electrodos indicadores, como los de membrana de vidrio, membrana de cristal y membrana de polímero, cada uno de ellos adecuado para diferentes necesidades analíticas.Sin embargo, el electrodo de calomelano sigue siendo un elemento básico en las aplicaciones de electrodos de referencia debido a su fiabilidad y sencillez a la hora de mantener un potencial estable.
Electrodo estándar de hidrógeno
El electrodo de hidrógeno estándar (SHE) es una referencia fundamental en electroquímica, ya que proporciona una base normalizada para determinar los valores de potencial eléctrico relativos de otros electrodos.A pesar de su estabilidad, el SHE es conocido por su complejidad operativa, que a menudo lo hace menos práctico para el uso rutinario en el laboratorio.
El SHE funciona en condiciones estándar, con gas hidrógeno a una presión de 1 atmósfera y una concentración de 1 M de iones de hidrógeno en solución.Esta configuración garantiza que el potencial del electrodo se mantenga constante y fiable.Sin embargo, la necesidad de un suministro constante de gas hidrógeno y el meticuloso mantenimiento necesario para mantener estas condiciones hacen que el SHE resulte engorroso y poco práctico para muchas aplicaciones.
Por el contrario, otros electrodos de referencia, como el electrodo de calomelano, ofrecen una alternativa más fácil de utilizar.Estos electrodos, aunque no son tan universalmente aplicables como el SHE, proporcionan un potencial de referencia estable y reproducible que resulta esencial para realizar mediciones precisas en química analítica.
La función principal del SHE es establecer un punto de referencia de potencial cero, con respecto al cual se pueden medir los potenciales de otros electrodos.Esta normalización es crucial para la interpretación precisa de los datos electroquímicos y es fundamental en el campo de la electroquímica.A pesar de sus limitaciones, el SHE sigue siendo una herramienta indispensable en la calibración y validación de instrumentos electroquímicos.
Electrodo patrón secundario
El electrodo de glicercurio, cuando se empareja con el electrodo estándar de hidrógeno, sirve como herramienta fiable para determinar su potencial de electrodo, ganándose así la designación de electrodo estándar secundario.Este emparejamiento permite realizar mediciones precisas, que son cruciales en química analítica, donde la precisión es primordial.
El electrodo de hidrógeno estándar (SHE) suele utilizarse como referencia para establecer el valor de potencial eléctrico relativo de otros electrodos.Sin embargo, el SHE es conocido por su estabilidad, pero resulta engorroso de manejar debido a su complejidad y a la necesidad de un suministro continuo de gas hidrógeno.En cambio, el electrodo de glicercurio ofrece una alternativa más práctica.
Cuando se utiliza junto con SHE, el electrodo de glicercurio puede determinar con precisión su potencial, convirtiéndolo en un patrón secundario.Esta capacidad es especialmente valiosa en química analítica, donde la reproducibilidad y la estabilidad son esenciales para obtener resultados fiables.El potencial del electrodo de glicercurio se ve influido por la concentración de iones cloruro, que puede controlarse y medirse con precisión, lo que contribuye a su exactitud.
Esta función estándar secundaria del electrodo de glicercurio subraya su importancia en los métodos potenciométricos, en los que a menudo actúa como electrodo indicador.Su capacidad para proporcionar mediciones de potencial precisas simplifica el proceso de calibración de otros electrodos, mejorando así la precisión general de las mediciones analíticas.
Usos y aplicaciones
Electrodo de referencia en potenciometría
El electrodo de glicercurio se emplea frecuentemente como electrodo de referencia en potenciometría, debido a su excepcional reproducibilidad y estabilidad.En las mediciones potenciométricas, el papel de un electrodo de referencia es primordial, ya que sirve como punto consistente y fiable con respecto al cual se mide el potencial de otros electrodos.Esta estabilidad es crucial para obtener lecturas precisas, ya que cualquier fluctuación en el potencial del electrodo de referencia puede dar lugar a resultados erróneos.
Para garantizar esta estabilidad, los electrodos de referencia están diseñados para mantener un potencial constante, idealmente en una escala absoluta.Esto se consigue gracias a dos características clave: un flujo de corriente mínimo y estar "bien polarizados".Un electrodo bien polarizado mantiene su potencial incluso cuando está sometido a pequeños flujos de corriente, lo que garantiza que su valor de referencia no se vea afectado.
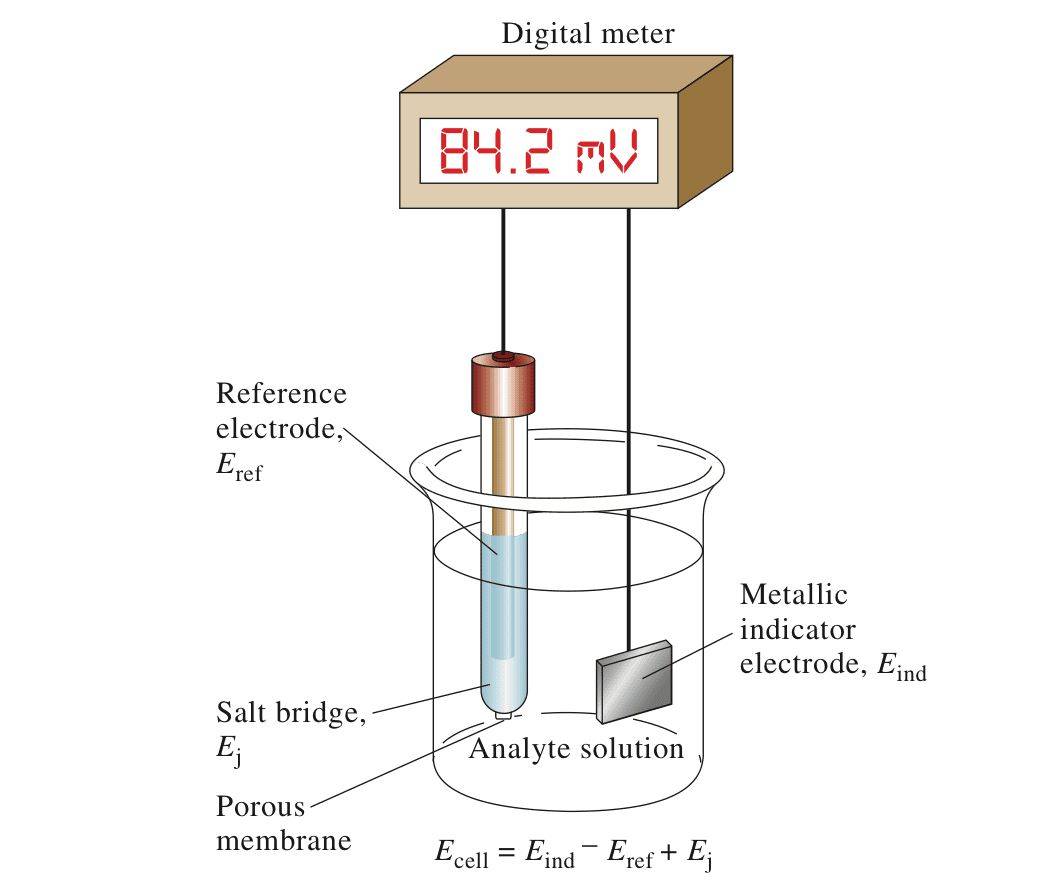
Aunque existen varios tipos de electrodos de referencia, algunos de los más utilizados y comercializados son los electrodos de plata/cloruro de plata, calomelanos saturados, óxido de mercurio/mercurio (mercurio), sulfato de mercurio/mercurio y sulfato de cobre/cobre.Estos electrodos son los preferidos por su fiabilidad y facilidad de uso en diversas aplicaciones analíticas.
En las valoraciones potenciométricas, la distinción entre electrodos indicadores y de referencia es fundamental.El electrodo indicador responde a los cambios en el analito, reflejando las variaciones de concentración, mientras que el electrodo de referencia permanece estable, proporcionando un potencial fijo.Esta configuración dual garantiza que las mediciones de potencial sean precisas y reproducibles, lo que convierte al electrodo de glicercurio en una opción ideal para estas aplicaciones.
Reacción del electrodo y símbolos
La reacción de electrodo para el electrodo de glicoruro es un proceso fundamental que implica la reducción del cloruro mercurioso (Hg₂Cl₂) a mercurio elemental (Hg) e iones cloruro (Cl-).Esta reacción puede representarse como:
Hg₂Cl₂ + 2e⁻ → 2Hg + 2Cl⁻
Este proceso electroquímico es crucial para la función del electrodo como referencia en química analítica.Los símbolos utilizados para describir el electrodo de glicercurio en una notación estándar son:
Pt | Hg(l) | Hg₂Cl₂(s) | KCl(saturated)
Aquí, los símbolos denotan:
- Pt:El hilo de platino inerte que actúa como colector de corriente.
- Hg(l):El mercurio líquido, que es el metal activo del electrodo.
- Hg₂Cl₂(s):El cloruro de mercurio sólido, que está en equilibrio con el mercurio.
- KCl(saturado):La solución saturada de cloruro de potasio, que proporciona los iones cloruro necesarios para la reacción del electrodo.
Esta notación es esencial para representar con precisión la composición del electrodo y las condiciones en las que funciona, garantizando la coherencia y la reproducibilidad de los montajes experimentales.
Limitaciones de temperatura
El electrodo de calomelano, aunque es muy fiable a temperaturas de laboratorio normales, presenta una notable inestabilidad cuando se somete a temperaturas elevadas.Concretamente, su valor potencial se vuelve errático por encima de los 70 °C, lo que lo hace inadecuado para mediciones precisas en tales condiciones.Además, una exposición prolongada a temperaturas superiores a 100°C puede acortar considerablemente la vida útil del electrodo.En consecuencia, es imperativo restringir el uso del electrodo de calomelano a temperaturas inferiores a 70 °C para garantizar tanto la precisión como la longevidad.
En aplicaciones prácticas, esta limitación requiere una cuidadosa consideración a la hora de seleccionar el electrodo adecuado para las distintas configuraciones experimentales.Por ejemplo, en la química analítica de alta temperatura, pueden preferirse electrodos de referencia alternativos con tolerancias de temperatura más amplias.Esto garantiza que la integridad de los datos recogidos no se vea comprometida por las limitaciones de temperatura inherentes al electrodo de calomelano.
Tipos de electrodos
Clasificación de los electrodos
Los electrodos pueden clasificarse a grandes rasgos en varias categorías en función de su composición y de la naturaleza de las reacciones electroquímicas que facilitan.Estas categorías incluyen electrodos de iones metálicos, electrodos de iones gaseosos, electrodos de sales insolubles metálicas y electrodos redox.Cada tipo tiene características y aplicaciones distintas en electroquímica.
-
Electrodos de iones metal-metal:Estos electrodos están formados por un metal sumergido en una solución que contiene sus propios iones.El potencial de estos electrodos viene determinado por la concentración de iones metálicos en la solución.
-
Electrodos de iones gaseosos:Estos electrodos utilizan un gas (como el hidrógeno o el cloro) en equilibrio con sus iones en solución.Un ejemplo típico es el electrodo de hidrógeno estándar (SHE), que se utiliza como electrodo de referencia universal.
-
Electrodos de sales insolubles metal-metal:Esta categoría incluye los electrodos en los que un metal está en contacto con una sal insoluble del metal y una solución que contiene el anión de la sal.El electrodo de glicercurio, que consiste en mercurio metálico en contacto con su sal insoluble Hg₂Cl₂ y una solución de cloruro potásico, entra en esta clasificación.El potencial de electrodo del electrodo de glicercurio se ve influido por la concentración de iones cloruro y es conocido por su estabilidad y reproducibilidad, lo que lo convierte en una elección popular como electrodo de referencia en potenciometría.
-
Electrodos redox:Estos electrodos implican un par redox en solución, donde la reacción redox se produce en un material de electrodo inerte como el platino.El potencial de un electrodo redox viene determinado por la relación entre las especies oxidadas y reducidas en la solución.
El electrodo de glicercurio, con su composición única y su potencial estable, es especialmente significativo en química analítica, donde sirve como electrodo de referencia fiable.Su clasificación como electrodo de sal insoluble metal-metal subraya su papel especializado en las mediciones electroquímicas y su compatibilidad con diversas técnicas analíticas.

Otros electrodos típicos
En el ámbito de los electrodos de sales insolubles metal-metal, el electrodo de cloruro de plata-plata destaca como contrapartida notable del electrodo de glicercurio.Este electrodo se utiliza ampliamente en diversas aplicaciones de química analítica debido a su estabilidad y reproducibilidad.
Composición y funcionalidad
El electrodo de plata-cloruro de plata consiste en un alambre de plata recubierto con una fina capa de cloruro de plata (AgCl), que se sumerge en una solución de cloruro de potasio (KCl).Esta configuración garantiza un potencial de electrodo estable, lo que lo convierte en una opción excelente para electrodos de referencia en mediciones potenciométricas.
| Componente | Papel |
|---|---|
| Alambre de plata | Proporciona la superficie conductora para la reacción del electrodo. |
| Cloruro de plata (AgCl) | Forma una capa estable e insoluble que contribuye a la estabilidad del electrodo. |
| Cloruro de potasio (KCl) | Actúa como electrolito, facilitando la conducción iónica. |
Reacción del electrodo
La reacción de electrodo para el electrodo de plata-cloruro de plata puede representarse como:
[ \text{AgCl} + \text{e}^- \rightarrow \text{Ag} + \text{Cl}^- ]
Esta reacción pone de manifiesto la transferencia de electrones del cloruro de plata al hilo de plata, manteniendo un potencial constante.
Aplicaciones
El electrodo de plata-cloruro de plata se emplea frecuentemente en:
- Medidas potenciométricas:Como electrodo de referencia fiable debido a su potencial estable.
- Control medioambiental:Para mediciones precisas del pH y de la concentración de iones en soluciones acuosas.
- Aplicaciones médicas y biológicas:En dispositivos que requieren potenciales eléctricos precisos y estables.
En resumen, el electrodo de plata-cloruro de plata, junto con el electrodo de glicercurio, desempeña un papel crucial en la categoría de electrodos de sales insolubles metal-metal, ofreciendo soluciones robustas para diversas necesidades de la química analítica.
Productos relacionados
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo electroquímico de carbono vítreo
- Electrodo de Hoja de Oro Electrodos de Oro para Electroquímica
- Electrodo de Disco de Oro
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
Artículos relacionados
- Principio de funcionamiento y aplicaciones del electrodo de referencia AgAgCl
- Una guía para principiantes para comprender los electrodos de referencia en electroquímica
- Cómo elegir el electrodo de referencia adecuado para su aplicación
- Guía completa de electrodos de referencia: Tipos, aplicaciones y criterios de selección
- Electrolitos y electrodos electroquímicos

















