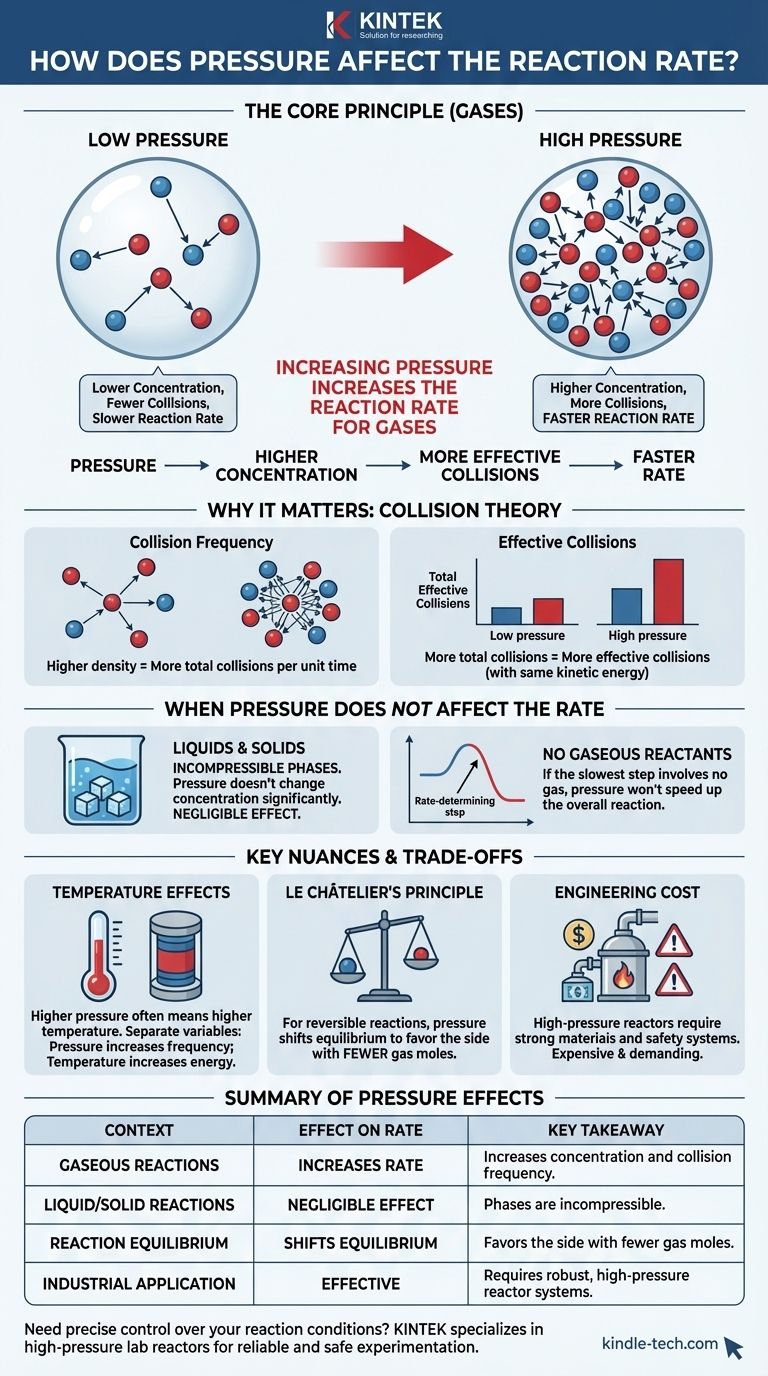
En resumen, aumentar la presión de una reacción que involucra gases aumenta la velocidad de reacción. Esto ocurre porque la presión es una medida directa de la concentración para los gases. Al comprimir las moléculas de gas en un volumen más pequeño, aumenta la probabilidad de que colisionen y reaccionen entre sí.
El principio fundamental es que, para las reacciones gaseosas, la presión actúa como una palanca directa sobre la concentración. Una mayor presión obliga a las moléculas de gas a estar más juntas, aumentando la frecuencia de colisiones efectivas y, por lo tanto, acelerando la reacción. Este efecto es insignificante para las reacciones en fase líquida o sólida.

El Mecanismo Fundamental: Por Qué Importa la Presión
Para comprender realmente el efecto de la presión, debemos volver a los primeros principios de cómo ocurren las reacciones químicas. Todo gira en torno al concepto de colisión de partículas.
La Presión como Medida de Concentración
Para los gases, la presión no es una fuerza abstracta; es el resultado de las moléculas de gas que chocan contra las paredes de su recipiente.
La Ley de los Gases Ideales muestra una relación directa entre la presión (P) y el número de moles (n) en un volumen dado (V) a una temperatura constante (T). Más moléculas en el mismo espacio significan más presión. Por lo tanto, aumentar la presión es funcionalmente lo mismo que aumentar la concentración.
El Papel de la Teoría de Colisiones
Las reacciones químicas ocurren cuando las partículas reactivas colisionan y se cumplen dos condiciones clave:
- Deben tener suficiente energía cinética para superar la barrera de energía de activación.
- Deben colisionar con la orientación física correcta.
Una colisión que cumple ambos criterios se denomina colisión efectiva. La velocidad de una reacción está determinada por la frecuencia de estas colisiones efectivas.
Más Presión = Más Colisiones
Cuando aumenta la presión de un sistema gaseoso, está forzando al mismo número de moléculas a un volumen más pequeño.
Esta mayor densidad significa que la distancia promedio entre las moléculas disminuye. En consecuencia, el número total de colisiones entre moléculas reactivas por unidad de tiempo aumenta significativamente.
El Impacto en las Colisiones "Efectivas"
Si bien aumentar la presión aumenta el número total de colisiones, no cambia la energía cinética de las moléculas individuales (suponiendo que la temperatura es constante).
Por lo tanto, el porcentaje de colisiones que son efectivas sigue siendo el mismo. Sin embargo, debido a que el número total de colisiones ha aumentado, el número absoluto de colisiones efectivas por segundo también aumenta. Esto es lo que impulsa la velocidad de reacción al alza.
Cuándo la Presión No Afecta la Velocidad
El vínculo entre la presión y la velocidad de reacción es poderoso, pero no es universal. Es fundamental saber cuándo no se aplica.
Reacciones en Fases Líquida y Sólida
Los líquidos y sólidos se consideran fases incompresibles. Aplicar presión externa no cambia significativamente su volumen ni el espaciado entre sus partículas constituyentes.
Debido a que los cambios de presión no alteran la concentración de reactivos en líquidos y sólidos, la presión tiene un efecto insignificante en las velocidades de las reacciones que ocurren únicamente en estas fases.
Reacciones Sin Reactivos Gaseosos
Si un mecanismo de reacción involucra múltiples pasos, la velocidad general está determinada por el paso más lento, conocido como el paso determinante de la velocidad.
Si este paso determinante de la velocidad no involucra reactivos gaseosos, los cambios en la presión externa no influirán en la velocidad general de la reacción.
Comprender las Compensaciones y los Matices
Controlar la presión es una estrategia industrial común, pero conlleva consideraciones importantes que van más allá de los simples cambios de velocidad.
Distinción de los Efectos de la Temperatura
En la práctica, comprimir un gas aumenta su temperatura. Tanto una mayor presión como una mayor temperatura aumentan las velocidades de reacción, pero por diferentes razones.
Es crucial aislar las variables. La presión aumenta la frecuencia de las colisiones, mientras que la temperatura aumenta la energía y la fuerza de esas colisiones, haciendo que un mayor porcentaje de ellas sean efectivas.
Principio de Le Châtelier y Equilibrio
Para las reacciones reversibles que alcanzan un estado de equilibrio, la presión juega un doble papel. Según el Principio de Le Châtelier, aumentar la presión desplazará la posición del equilibrio para favorecer el lado de la reacción con menos moles de gas.
Este es un concepto separado de la cinética (velocidad). La presión aumenta la velocidad tanto de la reacción directa como de la inversa, pero puede desplazar el equilibrio final de productos y reactivos.
El Costo de Ingeniería de la Alta Presión
Construir y mantener reactores de alta presión es tecnológicamente exigente y costoso. Los materiales deben ser lo suficientemente resistentes para soportar la tensión y se requieren sistemas de seguridad extensos para prevenir fallas catastróficas. Esta compensación económica y de seguridad es un factor importante en el diseño de procesos industriales.
Aplicación a Su Objetivo
Su enfoque para usar la presión depende completamente del sistema químico con el que está trabajando y de lo que está tratando de lograr.
- Si su enfoque principal es maximizar la velocidad de reacción para un proceso gaseoso: Aumentar la presión es un método directo y efectivo, siempre que pueda gestionar los cambios de temperatura asociados y los costos de ingeniería.
- Si está estudiando el equilibrio químico: Recuerde que la presión afecta tanto las velocidades de reacción como la posición final del equilibrio, favoreciendo el lado con menos moléculas de gas.
- Si su reacción involucra solo líquidos o sólidos: Cambiar la presión externa no es una estrategia viable para controlar la velocidad de reacción; concéntrese en la temperatura, la concentración o los catalizadores en su lugar.
Al comprender el vínculo directo de la presión con la concentración, obtiene una poderosa palanca para controlar la cinética de las reacciones gaseosas.
Tabla Resumen:
| Efecto de la Presión en la Velocidad de Reacción | Conclusión Clave |
|---|---|
| Reacciones Gaseosas | Aumenta la velocidad al aumentar la concentración y la frecuencia de colisión. |
| Reacciones Líquidas/Sólidas | Efecto insignificante; las fases son incompresibles. |
| Equilibrio de Reacción | Desplaza el equilibrio para favorecer el lado con menos moles de gas. |
| Aplicación Industrial | Efectivo pero requiere sistemas de reactores robustos y de alta presión. |
¿Necesita un control preciso de sus condiciones de reacción? KINTEK se especializa en reactores y equipos de laboratorio de alta presión diseñados para una experimentación confiable y segura. Ya sea que esté optimizando la velocidad de una reacción gaseosa o estudiando el equilibrio químico, nuestras soluciones brindan el rendimiento y la seguridad que necesita. Contacte a nuestros expertos hoy mismo para encontrar el sistema perfecto para los desafíos únicos de su laboratorio.
Guía Visual
Productos relacionados
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Reactor de Presión de Laboratorio Autoclave de Alta Presión de Acero Inoxidable
- Mini Reactor Autoclave de Alta Presión SS para Uso en Laboratorio
- Horno de tubo de vacío de alta presión de laboratorio
- Reactor Autoclave de Laboratorio de Alta Presión para Síntesis Hidrotermal
La gente también pregunta
- ¿Cuál es la función de un reactor hidrotermal de temperatura constante? Dominio de la Activación de Cenizas Volantes de Carbón
- ¿Cuál es el propósito de usar gas argón de alta pureza en un reactor de alta presión? Asegurar datos precisos de pruebas de corrosión
- ¿Por qué son necesarios los recipientes de reacción sellados de laboratorio en la síntesis hidrotermal de zeolitas? Asegurar la pureza y el rendimiento
- ¿Qué papel juega un autoclave en la simulación de las condiciones de un REAP? Validación avanzada de materiales para la seguridad nuclear
- ¿Cómo demuestra su valor un reactor de alta presión en el envejecimiento acelerado? Predicción rápida de la durabilidad del catalizador



















