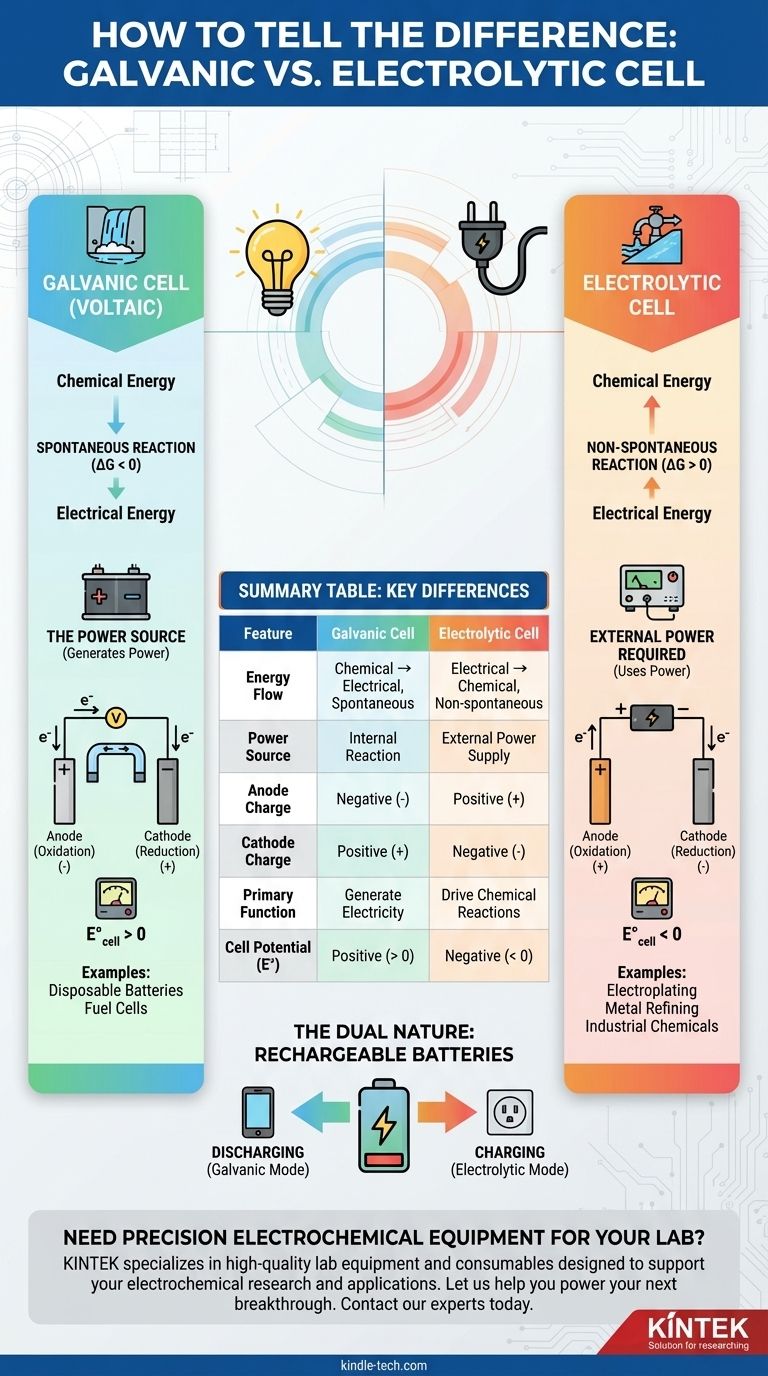
La diferencia fundamental entre una celda galvánica y una electrolítica radica en el flujo de energía. Una celda galvánica, también conocida como celda voltaica, utiliza una reacción química espontánea para generar energía eléctrica. En contraste, una celda electrolítica utiliza energía eléctrica externa para forzar que ocurra una reacción química no espontánea.
Piénsalo de esta manera: una celda galvánica es como una cascada que genera energía mientras fluye naturalmente cuesta abajo. Una celda electrolítica es como una bomba que utiliza energía externa para empujar el agua cuesta arriba contra la gravedad.

El Principio Central: Espontaneidad y Conversión de Energía
El comportamiento de cualquier celda electroquímica está dictado por si su reacción interna procede por sí sola o requiere intervención externa.
Celdas Galvánicas: Liberación de Energía Química
Una celda galvánica se define por una reacción redox espontánea. Esto significa que la reacción quiere ocurrir por sí misma, liberando energía en el proceso.
Este proceso convierte la energía química almacenada directamente en energía eléctrica. La celda en sí es la fuente de energía.
Termodinámicamente, esto corresponde a una energía libre de Gibbs negativa (ΔG < 0) y un potencial de celda positivo (E°_celda > 0).
Celdas Electrolíticas: Inyección de Energía Eléctrica
Una celda electrolítica implica una reacción no espontánea. Sin un impulso externo, esta reacción no se produciría.
Requiere una fuente de alimentación externa, como una batería o una fuente de corriente continua (CC), para impulsar la reacción. Este proceso convierte energía eléctrica en energía química.
Esto corresponde a una energía libre de Gibbs positiva (ΔG > 0) y un potencial de celda negativo (E°_celda < 0). El voltaje externo debe ser mayor que este potencial negativo para forzar la reacción.
Cómo Identificar Cada Celda: Indicadores Clave
Más allá de la dirección del flujo de energía, se pueden distinguir entre las dos celdas observando la polaridad de los electrodos y el circuito general.
La Fuente de Energía
Este es el indicador más sencillo. Si la celda electroquímica es la batería que alimenta un dispositivo, es una celda galvánica.
Si la celda está conectada a una batería externa o fuente de alimentación, es una celda electrolítica. La fuente externa proporciona la energía para impulsar el proceso.
Polaridad del Electrodo (Un Punto Común de Confusión)
Las definiciones de ánodo y cátodo son constantes para ambos tipos de celdas:
- Ánodo: El electrodo donde ocurre la oxidación.
- Cátodo: El electrodo donde ocurre la reducción.
Sin embargo, su carga positiva/negativa (polaridad) se invierte:
En una celda galvánica, la reacción espontánea en el ánodo libera electrones, convirtiéndolo en el terminal negativo (-). El cátodo, que consume electrones, es el terminal positivo (+).
En una celda electrolítica, la fuente de alimentación externa dicta la polaridad. Extrae electrones del ánodo, convirtiéndolo en el terminal positivo (+), e inyecta electrones al cátodo, convirtiéndolo en el terminal negativo (-).
Aplicaciones Comunes y Errores Frecuentes
El propósito de la celda es su diferenciador más práctico. Una genera energía, mientras que la otra utiliza energía para crear una sustancia o realizar un cambio.
El Propósito de una Celda Galvánica
La única función de una celda galvánica es actuar como fuente de energía eléctrica.
Los ejemplos comunes incluyen baterías desechables (AA, AAA), pilas de combustible y la función principal de la batería de un automóvil al arrancar el motor.
El Propósito de una Celda Electrolítica
El objetivo de una celda electrolítica es impulsar una transformación química útil que no ocurriría de otra manera.
Las aplicaciones típicas incluyen el recubrimiento electrolítico de una fina capa de metal sobre una superficie, la refinación de metales como el cobre y el aluminio, y la producción de productos químicos industriales como el gas cloro.
La Naturaleza Dual de las Baterías Recargables
Una batería recargable es el ejemplo perfecto de ambos tipos de celdas en un solo dispositivo.
- Al descargarse (alimentando su teléfono): Actúa como una celda galvánica, con una reacción espontánea que genera electricidad.
- Al cargarse (conectada a la pared): Actúa como una celda electrolítica, con energía externa forzando la reacción inversa no espontánea para almacenar energía.
Haciendo la Distinción Correcta para su Objetivo
Para determinar rápidamente con qué celda está tratando, concéntrese en el flujo de energía y el objetivo general del sistema.
- Si su enfoque principal es generar energía: Está tratando con una celda galvánica, donde una reacción espontánea libera energía.
- Si su enfoque principal es crear una sustancia o revertir una reacción: Está utilizando una celda electrolítica, que requiere una fuente de energía externa para impulsar un proceso no espontáneo.
- Si está analizando los signos de los electrodos: Recuerde que en una celda galvánica el ánodo es negativo, mientras que en una celda electrolítica es positivo, debido a que la fuente de energía es interna o externa.
En última instancia, comprender si la energía es un producto o un requisito es la clave para distinguir entre estas dos celdas electroquímicas fundamentales.
Tabla Resumen:
| Característica | Celda Galvánica | Celda Electrolítica |
|---|---|---|
| Flujo de Energía | Química → Eléctrica (Espontánea) | Eléctrica → Química (No espontánea) |
| Fuente de Energía | Reacción Interna | Fuente de Alimentación Externa |
| Carga del Ánodo | Negativa (-) | Positiva (+) |
| Carga del Cátodo | Positiva (+) | Negativa (-) |
| Función Principal | Generar Electricidad | Impulsar Reacciones Químicas (ej. galvanoplastia) |
| Potencial de Celda (E°) | Positivo (> 0) | Negativo (< 0) |
¿Necesita Equipos Electroquímicos de Precisión para su Laboratorio?
Comprender los matices de las celdas galvánicas y electrolíticas es crucial para el trabajo de laboratorio avanzado. Ya sea que esté desarrollando nuevas tecnologías de baterías, realizando galvanoplastia o llevando a cabo análisis de materiales, contar con el equipo adecuado es esencial.
KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad diseñados para apoyar su investigación y aplicaciones electroquímicas. Proporcionamos soluciones confiables que aseguran resultados precisos y mejoran la eficiencia de su laboratorio.
Permítanos ayudarle a impulsar su próximo gran avance. Contacte a nuestros expertos hoy mismo para discutir sus necesidades específicas de laboratorio y descubrir cómo nuestros productos pueden impulsar su éxito.
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Equipo de laboratorio de baterías Probador integral de capacidad y baterías
- Papel de Carbono Hidrofílico TGPH060 para Aplicaciones de Laboratorio de Baterías
La gente también pregunta
- ¿Cómo debe asegurarse la celda electrolítica en el soporte durante un experimento? Una guía paso a paso para la estabilidad
- ¿Cuáles son los beneficios de usar celdas electrolíticas de flujo? Escalado de la síntesis de nanomateriales con precisión y eficiencia
- ¿Qué propiedades mecánicas y físicas específicas se requieren para los separadores tejidos de PPS en celdas electrolíticas de espacio cero?
- ¿Qué papel juega un sistema de celda electrolítica en la pre-carga de hidrógeno en metales? Acelere las pruebas de materiales con KINTEK
- ¿Cómo funciona una celda electrolítica de tres electrodos durante las pruebas PEC? Optimización del análisis del fotoánodo de MoS2
- ¿Cuál es la función de una celda electrolítica en el enriquecimiento de tritio? Mejora la detección para análisis de bajo nivel
- ¿Cuáles son las ventajas de diseño de una celda electrolítica de tres electrodos? Logre precisión en la fotoelectrólisis
- ¿Qué tipos de electrodos se utilizan en la celda electrolítica? Elija el sistema adecuado para su laboratorio




