En esencia, la electrólisis es el proceso de usar energía eléctrica para impulsar una reacción química que no ocurriría por sí sola. Una fuente de energía externa aplica un voltaje a través de dos electrodos sumergidos en una solución conductora o sal fundida, llamada electrolito. Esta energía aplicada fuerza a los iones a migrar a electrodos con carga opuesta, donde sufren descomposición a través de reacciones de oxidación y reducción.
Una celda electrolítica es un motor para revertir reacciones químicas. Al aplicar energía externa, fuerza a los electrones a fluir en contra de su tendencia natural, obligando a los compuestos químicos estables a descomponerse en sus elementos constituyentes.

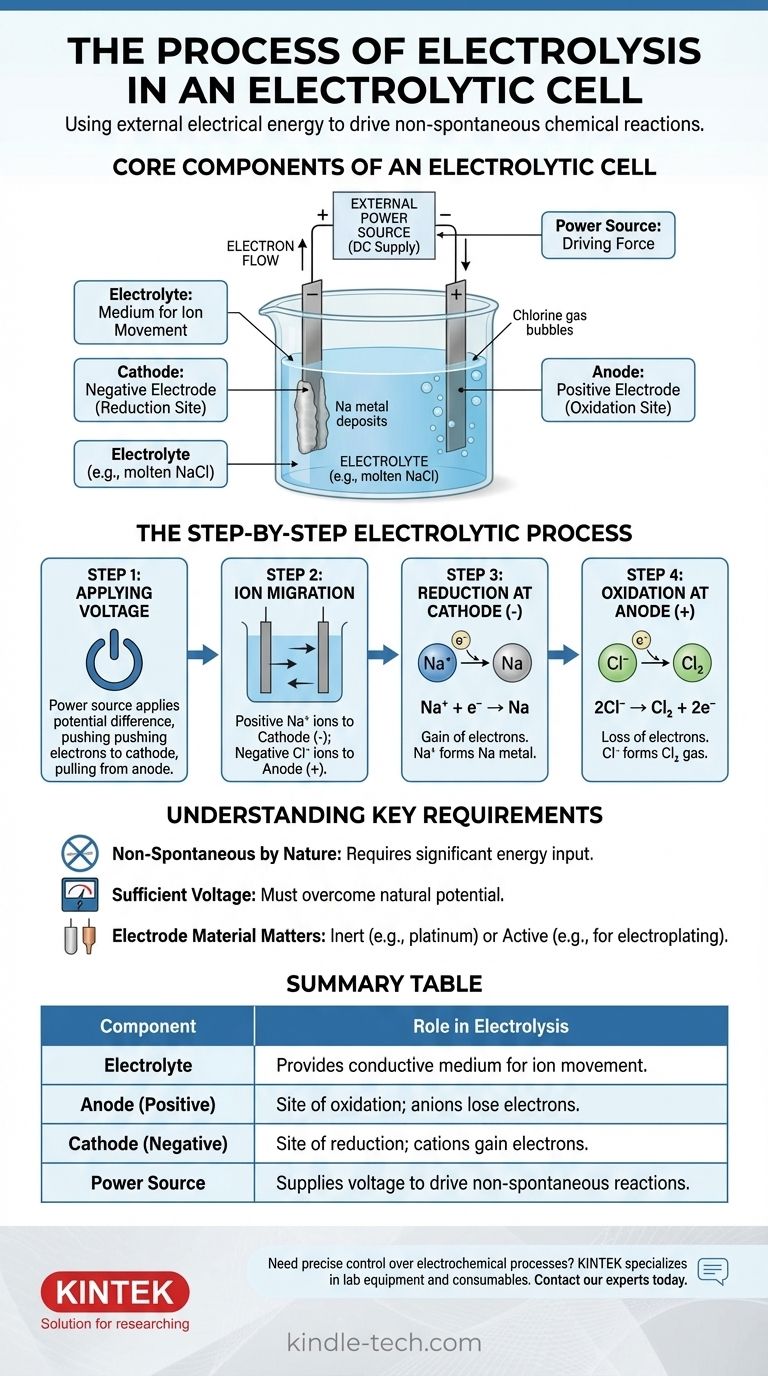
Los componentes principales de una celda electrolítica
Para comprender el proceso, primero debe comprender la función de cada parte. El sistema es una interacción cuidadosamente orquestada entre tres componentes clave.
El electrolito: un medio para el movimiento de iones
El electrolito es una sustancia que contiene iones de libre movimiento, lo que la hace eléctricamente conductora. Típicamente es un compuesto iónico fundido, como el cloruro de sodio (NaCl), o una solución acuosa que contiene iones disueltos.
El único propósito del electrolito es proporcionar un medio a través del cual los iones cargados puedan viajar entre los electrodos.
Los electrodos: ánodo y cátodo
Los electrodos son materiales conductores (a menudo metales o grafito) que se sumergen en el electrolito. Sirven como la interfaz física donde el circuito eléctrico se encuentra con la solución química.
En una celda electrolítica, la polaridad se define por la fuente de energía externa:
- El Ánodo es el electrodo positivo.
- El Cátodo es el electrodo negativo.
La fuente de energía externa: la fuerza impulsora
Esta es típicamente una batería o una fuente de alimentación de CC. Su trabajo es crear una diferencia de potencial a través de los electrodos, forzando a los electrones a moverse en una dirección que no lo harían espontáneamente.
Este voltaje externo es la "bomba" que impulsa toda la reacción no espontánea, superando la estabilidad química natural del electrolito.
El proceso electrolítico paso a paso
El proceso se desarrolla en una secuencia precisa una vez que se activa la fuente de energía. Podemos ilustrar esto usando el ejemplo del cloruro de sodio (NaCl) fundido.
Paso 1: Aplicación del voltaje
Se aplica un voltaje externo. La fuente de energía empuja los electrones hacia un electrodo, haciéndolo cargado negativamente (el cátodo), y tira los electrones del otro, haciéndolo cargado positivamente (el ánodo).
Paso 2: Migración de iones
Dentro del electrolito de NaCl fundido, el sodio existe como iones positivos (cationes, Na⁺) y el cloruro existe como iones negativos (aniones, Cl⁻).
Los opuestos se atraen: los cationes Na⁺ positivos son atraídos hacia el cátodo negativo, mientras que los aniones Cl⁻ negativos son atraídos hacia el ánodo positivo.
Paso 3: Reducción en el cátodo (el electrodo negativo)
Cuando los cationes Na⁺ llegan al cátodo cargado negativamente, cada uno gana un electrón suministrado por la fuente de energía. Esta ganancia de electrones es una reacción de reducción.
Los iones Na⁺ se reducen para formar sodio metálico neutro (Na), que se deposita en el cátodo.
Paso 4: Oxidación en el ánodo (el electrodo positivo)
Simultáneamente, cuando los aniones Cl⁻ llegan al ánodo cargado positivamente, cada uno cede un electrón al electrodo. Esta pérdida de electrones es una reacción de oxidación.
Los iones Cl⁻ se oxidan para formar átomos de cloro neutros, que se unen para convertirse en gas cloro (Cl₂) que burbujea lejos del ánodo. Los electrones liberados viajan a través del circuito externo de regreso a la fuente de energía, completando el circuito.
Comprendiendo los requisitos clave
La electrólisis es potente pero opera bajo restricciones específicas. Ignorarlas puede llevar a experimentos fallidos o a una mala interpretación de los resultados.
No espontáneo por naturaleza
El principio fundamental es que la electrólisis impulsa una reacción no espontánea. La descomposición de la sal en sodio metálico y gas cloro, por ejemplo, requiere una entrada significativa de energía. Sin el voltaje externo, no pasaría nada.
La necesidad de un voltaje suficiente
La fuente de energía externa debe suministrar un voltaje lo suficientemente alto como para superar el potencial natural de la reacción química. Si el voltaje es demasiado bajo, no será lo suficientemente fuerte como para forzar la migración de iones y la transferencia de electrones, y la reacción no procederá.
El material del electrodo importa
Para la descomposición simple, se utilizan electrodos inertes (como platino o carbono). Estos materiales facilitan la transferencia de electrones sin participar ellos mismos en la reacción. En otras aplicaciones, como la galvanoplastia, el ánodo puede ser un electrodo "activo" diseñado para oxidarse y disolverse en el electrolito.
Aplicando esto a ejemplos comunes
Los principios de la electrólisis son universales, pero los productos específicos dependen enteramente del electrolito utilizado.
- Si su objetivo es producir metales puros: Utilice una sal fundida de ese metal como electrolito. El metal puro se reducirá y depositará en el cátodo, como se ve en la producción industrial de sodio y aluminio.
- Si su objetivo es descomponer agua: Use agua con una pequeña cantidad de un ácido o sal para mejorar la conductividad. Este proceso producirá gas hidrógeno (H₂) en el cátodo y gas oxígeno (O₂) en el ánodo.
- Si su objetivo es galvanizar un objeto: El objeto a galvanizar se establece como el cátodo. Los iones metálicos de la solución electrolítica se reducen sobre la superficie del objeto, formando un recubrimiento metálico delgado y uniforme.
Al controlar el flujo de electrones, podemos controlar y revertir directamente los procesos químicos, una capacidad fundamental que sustenta gran parte de la industria moderna.
Tabla resumen:
| Componente | Función en la electrólisis |
|---|---|
| Electrolito | Proporciona un medio conductor para el movimiento de iones (p. ej., NaCl fundido). |
| Ánodo (Positivo) | Sitio de oxidación; los aniones pierden electrones (p. ej., Cl⁻ → gas Cl₂). |
| Cátodo (Negativo) | Sitio de reducción; los cationes ganan electrones (p. ej., Na⁺ → metal Na). |
| Fuente de energía | Suministra voltaje para impulsar reacciones no espontáneas. |
¿Necesita un control preciso sobre los procesos electroquímicos? KINTEK se especializa en equipos y consumibles de laboratorio para electrólisis, galvanoplastia y síntesis de materiales. Nuestras fuentes de alimentación confiables, electrodos y soluciones electrolíticas le ayudan a lograr resultados consistentes, ya sea que esté descomponiendo compuestos, refinando metales o recubriendo superficies. Contacte a nuestros expertos hoy para discutir las necesidades específicas de su laboratorio.
Guía Visual
Productos relacionados
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Celda de Flujo Personalizable para Reducción de CO2 para Investigación de NRR, ORR y CO2RR
- Carcasa de batería de litio-aire para aplicaciones de laboratorio de baterías
La gente también pregunta
- ¿Cómo se configura la celda de tres electrodos para la prueba de corrosión de aleaciones de Ni-Cr-Co-Ti-V? Optimice la configuración de su investigación
- ¿Cuáles son las ventajas de utilizar un sistema de celda microelectrolítica? Optimizar la caracterización de aleaciones de Mg-Ag
- ¿Cuál es el papel de un reactor de vidrio en la electrólisis del agua alcalina? Garantizar la seguridad y la precisión visual
- ¿Cuáles son las propiedades del material del cuerpo de la celda electrolítica de acrílico? | Claridad, seguridad y resistencia química
- ¿Por qué se utilizan reactores de celdas de combustible en sistemas electroquímicos para la producción de peróxido de hidrógeno? Maximizar la eficiencia
- ¿Cuáles son las especificaciones de las aberturas en la celda electrolítica tipo H?
- ¿Se desgasta el galvanizado? Comprendiendo la durabilidad y vida útil de los acabados galvanizados
- ¿Cómo funciona una celda electrolítica de tres electrodos durante las pruebas PEC? Optimización del análisis del fotoánodo de MoS2



















