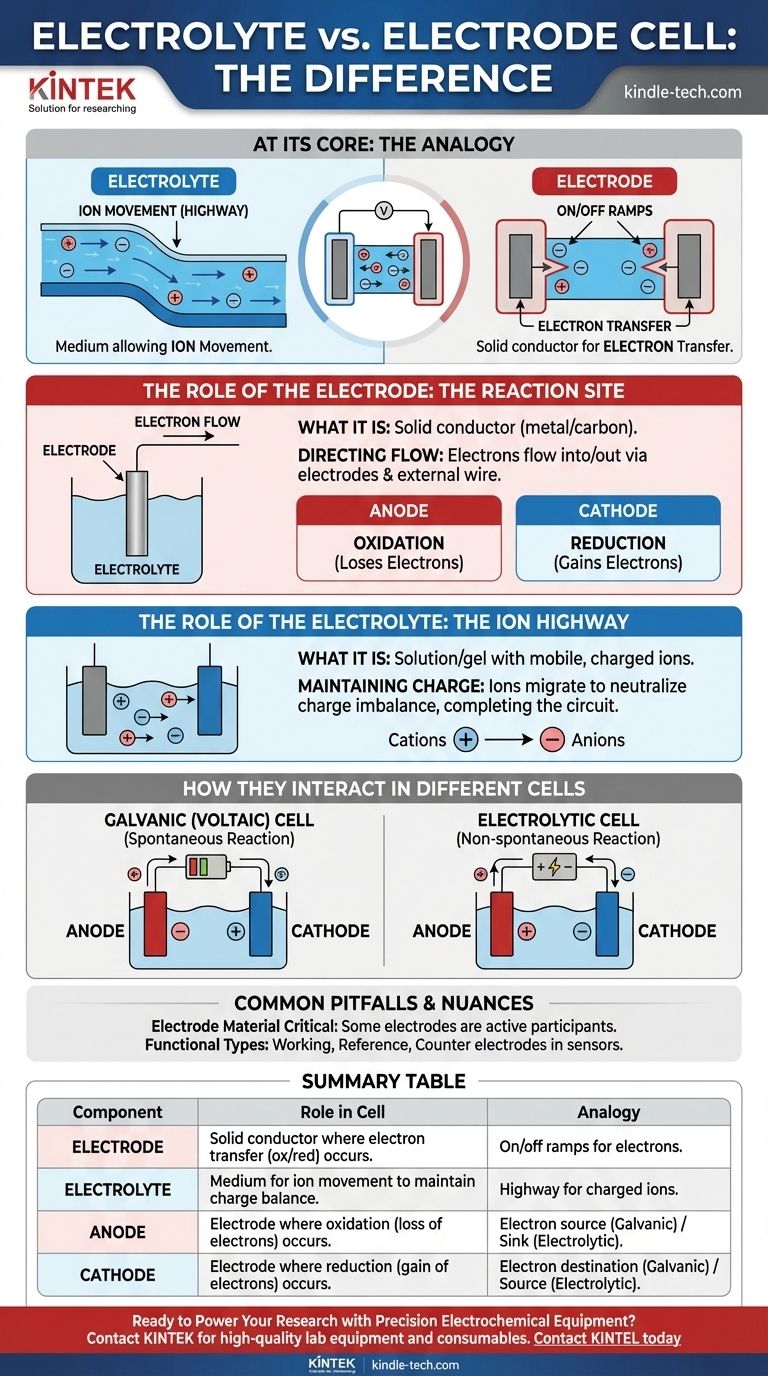
En esencia, un electrolito es el medio que permite el movimiento de los iones, mientras que un electrodo es el conductor físico donde realmente ocurren la reacción química y la transferencia de electrones. El electrolito es la "autopista" para los iones cargados dentro de la celda, y los electrodos son las "rampas de entrada y salida" que conectan esa autopista con el circuito eléctrico externo.
En cualquier celda electroquímica, los electrodos son los conductores sólidos donde ocurren las reacciones químicas, ya sea liberando o consumiendo electrones. El electrolito es el medio líquido o gel necesario que transporta iones entre estos electrodos, completando el circuito eléctrico.

El Papel del Electrodo: El Sitio de Reacción
Un electrodo actúa como la interfaz física entre los componentes químicos dentro de una celda y el circuito electrónico externo.
Qué es un Electrodo
Un electrodo es un conductor eléctrico sólido, típicamente un metal o carbono, colocado en el electrolito. Su función es transferir electrones hacia o desde las especies en la solución.
Dirigiendo el Flujo de Electrones
Los electrones no pueden viajar a través del electrolito. En cambio, fluyen hacia o desde la celda a través de los electrodos y el cable externo conectado.
Ánodo vs. Cátodo
Todas las celdas tienen dos tipos de electrodos definidos por la reacción que ocurre en su superficie:
- El ánodo es donde ocurre la oxidación (una sustancia pierde electrones).
- El cátodo es donde ocurre la reducción (una sustancia gana electrones).
El Papel del Electrolito: La Autopista de Iones
El electrolito es tan crucial como los electrodos. Sin él, el circuito está incompleto y no puede fluir corriente.
Qué es un Electrolito
Un electrolito es una sustancia, típicamente una solución que contiene sales, ácidos o bases, que produce una solución conductora de electricidad cuando se disuelve. Contiene iones móviles y cargados.
Manteniendo la Neutralidad de Carga
A medida que los electrones se liberan en el ánodo y se consumen en el cátodo, un desequilibrio de carga se acumularía rápidamente y detendría la reacción. El electrolito evita esto permitiendo que sus iones migren entre los electrodos, neutralizando la carga y permitiendo que el proceso continúe.
Cómo Interactúan en Diferentes Celdas
La carga específica del ánodo y el cátodo depende de si la celda está generando o consumiendo electricidad.
En Celdas Galvánicas (Voltaicas)
Estas celdas, como las baterías comunes, convierten la energía química en energía eléctrica a través de una reacción espontánea.
- El ánodo es negativo, ya que es la fuente de electrones para el circuito externo.
- El cátodo es positivo, ya que es donde los electrones regresan a la celda.
En Celdas Electrolíticas
Estas celdas utilizan energía eléctrica externa para impulsar una reacción no espontánea, como en la galvanoplastia o la división del agua.
- El ánodo es positivo, ya que está conectado al terminal positivo de la fuente de alimentación externa para extraer electrones.
- El cátodo es negativo, ya que está conectado al terminal negativo para forzar la entrada de electrones.
Errores Comunes y Matices
Comprender las definiciones básicas es el primer paso. Reconocer los matices es lo que lleva a una verdadera comprensión.
El Material del Electrodo es Crítico
El electrodo no siempre es solo un conductor inerte. En muchas baterías, el material del electrodo en sí es un participante activo en la reacción química, como la carcasa de zinc de una batería alcalina que actúa como ánodo.
Tipos de Electrodos Funcionales
En química analítica y aplicaciones de sensores, los electrodos reciben nombres más específicos basados en su función.
- Un electrodo de trabajo es donde ocurre la reacción química de interés.
- Un electrodo de referencia proporciona un potencial estable y constante para medir.
- Un contraelectrodo completa el circuito, pasando corriente al electrodo de trabajo.
Haciendo la Distinción Correcta para Tu Objetivo
Para aplicar este conocimiento, concéntrate en el papel fundamental que juega cada componente dentro de tu contexto específico.
- Si tu enfoque principal es la ciencia básica de las baterías: Considera el electrodo como el sitio de ganancia/pérdida de electrones (ánodo/cátodo) y el electrolito como el transportador esencial de iones que mantiene la batería en funcionamiento.
- Si tu enfoque principal es realizar electrólisis: Recuerda que la polaridad (+/-) de los electrodos se invierte con respecto a una batería, pero sus roles químicos fundamentales (ánodo=oxidación, cátodo=reducción) permanecen exactamente iguales.
- Si tu enfoque principal es construir sensores electroquímicos: Debes distinguir entre el electrodo de trabajo (donde ocurre el evento), el electrodo de referencia (para una medición estable) y el contraelectrodo (para completar el circuito).
En última instancia, el electrodo y el electrolito son dos componentes distintos pero inseparables que forman la base de toda la tecnología electroquímica.
Tabla Resumen:
| Componente | Función en una Celda Electroquímica | Analogía |
|---|---|---|
| Electrodo | Conductor sólido donde ocurre la transferencia de electrones (oxidación/reducción). | Rampas de entrada/salida para los electrones al circuito externo. |
| Electrolito | Medio (líquido/gel) que permite el movimiento de iones para mantener el equilibrio de carga. | Autopista para los iones cargados dentro de la celda. |
| Ánodo | Electrodo donde ocurre la oxidación (pérdida de electrones). | Fuente de electrones (Galvánica) o sumidero de electrones (Electrolítica). |
| Cátodo | Electrodo donde ocurre la reducción (ganancia de electrones). | Destino de electrones (Galvánica) o fuente de electrones (Electrolítica). |
¿Listo para Impulsar Tu Investigación con Equipos Electroquímicos de Precisión?
Comprender los fundamentos es el primer paso. Aplicarlos con las herramientas adecuadas es lo que impulsa el descubrimiento. Ya sea que estés desarrollando nuevos materiales para baterías, realizando electrólisis precisa o construyendo sensores sensibles, KINTEK proporciona el equipo de laboratorio y los consumibles de alta calidad que necesitas.
Nos especializamos en satisfacer las necesidades precisas de los laboratorios. Permítenos ayudarte a seleccionar las celdas electroquímicas, electrodos y electrolitos perfectos para asegurar resultados precisos y confiables para tu aplicación específica.
Contacta a KINTEK hoy mismo para discutir los requisitos de tu proyecto y descubrir cómo nuestras soluciones pueden mejorar las capacidades de tu laboratorio.
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Célula electrolítica electroquímica de cinco puertos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celdas de Prueba Tipo Swagelok Personalizables para Investigación Avanzada de Baterías y Análisis Electroquímico
La gente también pregunta
- ¿Cuál es la función principal de una celda electrolítica de tres electrodos? Aislar y optimizar el rendimiento del dispositivo PEC
- ¿Qué precauciones de seguridad son necesarias durante un experimento de electrólisis? Una guía para gestionar los peligros químicos, eléctricos y físicos
- ¿Por qué es importante evitar el cortocircuito de los electrodos en una celda electrolítica? Prevenir fallos catastróficos del equipo
- ¿Qué papel juega una estación de trabajo electroquímica de alta precisión en el proceso de lixiviación de imanes Sm2(Co,Fe,Cu,Zr)17?
- ¿Por qué se utiliza una celda electrolítica de vidrio tipo H de doble cámara en la electrólisis de glicerol? Asegurar el aislamiento puro del producto
- ¿Cómo afectan el espaciado de los electrodos y las conexiones paralelas monopolares al rendimiento electrolítico? Optimice la energía y la eficiencia
- ¿Cómo se deben manipular los contenidos de una celda electrolítica totalmente de PTFE? Guía esencial de limpieza post-experimento
- ¿Cómo deben manejarse los productos y residuos de la celda electrolítica después de un experimento? Una guía de seguridad y mantenimiento



















