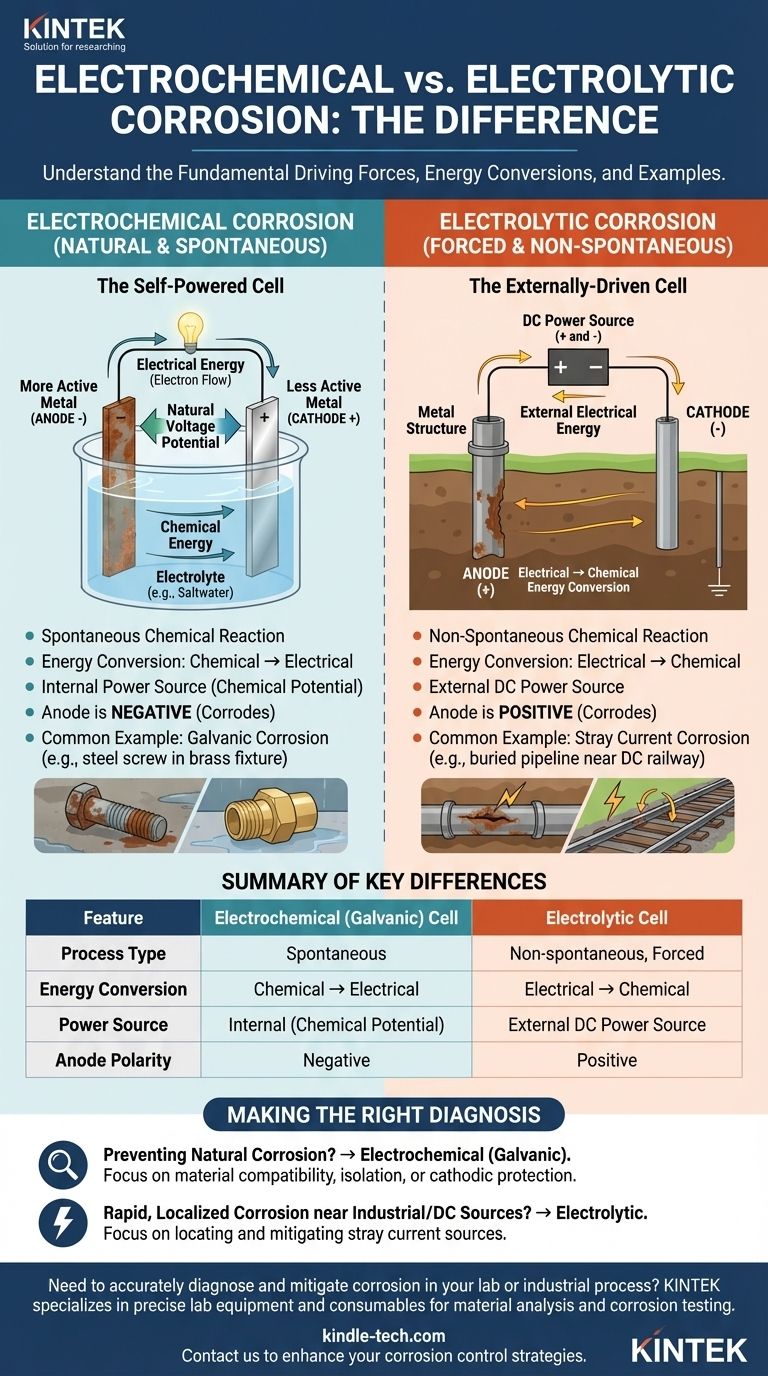
A un nivel fundamental, la diferencia entre una celda de corrosión electrolítica y una electroquímica radica en su conversión de energía y su fuerza impulsora. Una celda electroquímica es un proceso espontáneo que convierte la energía química almacenada en energía eléctrica, causando corrosión natural. En contraste, una celda electrolítica es un proceso no espontáneo que utiliza energía eléctrica externa para forzar una reacción química, causando corrosión inducida.
La distinción principal es la espontaneidad. La corrosión electroquímica ocurre naturalmente por sí misma, como una batería descargándose. La corrosión electrolítica es forzada sobre un material por una fuente de energía externa, como una corriente continua parásita de un sistema ferroviario.

La Celda Electroquímica: El Estado Natural de la Corrosión
Una celda electroquímica, a menudo llamada celda galvánica, es el mecanismo detrás de las formas más comunes de corrosión. Es un proceso autónomo y de origen natural.
Una Reacción Química Espontánea
Este tipo de celda se forma cuando dos metales diferentes están en contacto eléctrico en presencia de un electrolito (como agua salada). Existe un potencial de voltaje natural entre ellos.
El metal más químicamente activo se convierte en el ánodo (electrodo negativo) y se corroe, liberando electrones. El metal menos activo se convierte en el cátodo (electrodo positivo) y acepta estos electrones.
Conversión de Energía: Química a Eléctrica
La fuerza impulsora es la liberación de energía química almacenada dentro del metal más activo. Esta energía química se convierte directamente en energía eléctrica en forma de flujo de electrones del ánodo al cátodo. Este proceso no requiere energía externa.
Un ejemplo clásico es la corrosión galvánica, donde un tornillo de acero (ánodo) se oxida rápidamente cuando se conecta a un accesorio de latón (cátodo) en un ambiente húmedo.
La Celda Electrolítica: Corrosión por Fuerza
Una celda electrolítica impulsa una reacción química que normalmente no ocurriría. Lo hace aplicando una fuente externa de energía eléctrica.
Una Reacción Química No Espontánea
Este proceso supera las tendencias naturales de los materiales involucrados. La fuente de energía externa fuerza a un metal a convertirse en ánodo y corroerse, incluso si de otro modo sería estable.
La corrosión ocurre donde esta corriente continua (CC) suministrada externamente abandona la estructura metálica para entrar en un electrolito.
Conversión de Energía: Eléctrica a Química
Aquí, la energía eléctrica de una fuente externa se convierte en energía química, que se manifiesta como la reacción de corrosión. La celda consume energía para funcionar.
Un escenario común en el mundo real es la corrosión por corriente parásita. Una tubería enterrada que pasa cerca de una vía férrea alimentada por CC puede captar corriente de fuga, forzando la sección de la tubería donde la corriente sale hacia el suelo a corroerse a un ritmo acelerado.
Entendiendo las Diferencias Clave
Aunque ambos procesos involucran ánodos, cátodos y un electrolito, sus características fundamentales son opuestas. Reconocer estas diferencias es fundamental para un diagnóstico y mitigación adecuados.
Fuerza Impulsora y Fuente de Energía
La distinción más importante es la fuerza impulsora. Una celda electroquímica es autoalimentada por la diferencia de potencial químico entre los materiales. Una celda electrolítica es alimentada externamente por una fuente de CC externa.
Polaridad de los Electrodos
La polaridad del ánodo y el cátodo se invierte entre las dos celdas, un punto frecuente de confusión.
- En una celda electroquímica (galvánica), el ánodo (donde ocurre la corrosión) es negativo, y el cátodo es positivo.
- En una celda electrolítica, la fuente de energía externa hace que el ánodo (donde ocurre la corrosión) sea positivo, y el cátodo es negativo.
Implicaciones Prácticas
Identificar erróneamente el tipo de celda de corrosión conduce a soluciones incorrectas. Por ejemplo, cambiar pares de materiales podría resolver un problema de corrosión galvánica, pero no hará nada para detener la corrosión por corriente parásita.
Haciendo el Diagnóstico Correcto
Comprender el mecanismo subyacente es el primer paso hacia un control eficaz de la corrosión. Su enfoque de diagnóstico debe guiarse por el tipo de celda sospechoso.
- Si su enfoque principal es prevenir la corrosión natural: Probablemente esté tratando con una celda electroquímica (galvánica). Su solución implica seleccionar materiales compatibles, aislarlos eléctricamente o aplicar protección catódica.
- Si está investigando una corrosión rápida y localizada cerca de equipos industriales o tránsito de CC: Es casi seguro que está tratando con una celda electrolítica. Su prioridad debe ser localizar y mitigar la fuente de la corriente parásita externa.
En última instancia, saber si la corrosión ocurre de forma natural o es forzada por una influencia externa dicta toda su estrategia de prevención y control.
Tabla Resumen:
| Característica | Celda Electroquímica (Galvánica) | Celda Electrolítica |
|---|---|---|
| Tipo de Proceso | Espontáneo | No espontáneo, Forzado |
| Conversión de Energía | Química → Eléctrica | Eléctrica → Química |
| Fuente de Energía | Interna (Potencial Químico) | Fuente de Alimentación de CC Externa |
| Polaridad del Ánodo | Negativa | Positiva |
| Ejemplo Común | Corrosión Galvánica (ej., acero/latón) | Corrosión por Corriente Parásita (ej., de vías férreas) |
¿Necesita diagnosticar y mitigar con precisión la corrosión en su laboratorio o proceso industrial?
Comprender el tipo exacto de celda de corrosión es el primer paso para una solución eficaz. Los expertos de KINTEK se especializan en proporcionar el equipo de laboratorio y los consumibles precisos necesarios para el análisis de materiales y las pruebas de corrosión. Ya sea que esté investigando reacciones galvánicas o efectos de corrientes parásitas, tenemos las herramientas para respaldar su investigación y garantizar la integridad del material.
Contáctenos hoy a través de nuestro formulario de contacto para discutir sus necesidades específicas de laboratorio y descubrir cómo las soluciones de KINTEK pueden mejorar sus estrategias de control de la corrosión.
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica para corrosión plana
- Célula electrolítica electroquímica de cinco puertos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Cómo se deben mantener los electrodos de la celda electrolítica tipo H? Guía esencial para la precisión y la longevidad
- ¿Cuál es la importancia de las pruebas EIS para catalizadores compuestos? Optimice la transferencia de carga con estaciones de trabajo de precisión
- ¿Cuáles son los procedimientos posteriores al uso para una celda electrolítica de baño de agua de cinco puertos? Garantizar la seguridad y la longevidad
- ¿Cómo influye un sistema de CC de dos electrodos en la calidad del recubrimiento? Lograr cromo trivalente denso en acero inoxidable 304L
- ¿Cómo se utiliza una celda electrolítica de alta precisión para evaluar la resistencia a la corrosión de los metales? Valide los resultados de DCT con precisión
- ¿Por qué es importante el control de voltaje y cuáles son los riesgos? Garantice la seguridad y la longevidad de sus sistemas electroquímicos
- ¿Cuáles son los tres componentes esenciales que componen una celda electrolítica? Elementos Clave de la Síntesis Química
- ¿Cuál es el mecanismo de la celda electrolítica dual de Devanathan-Stachurski? Explore las pruebas precisas de permeación de hidrógeno



















