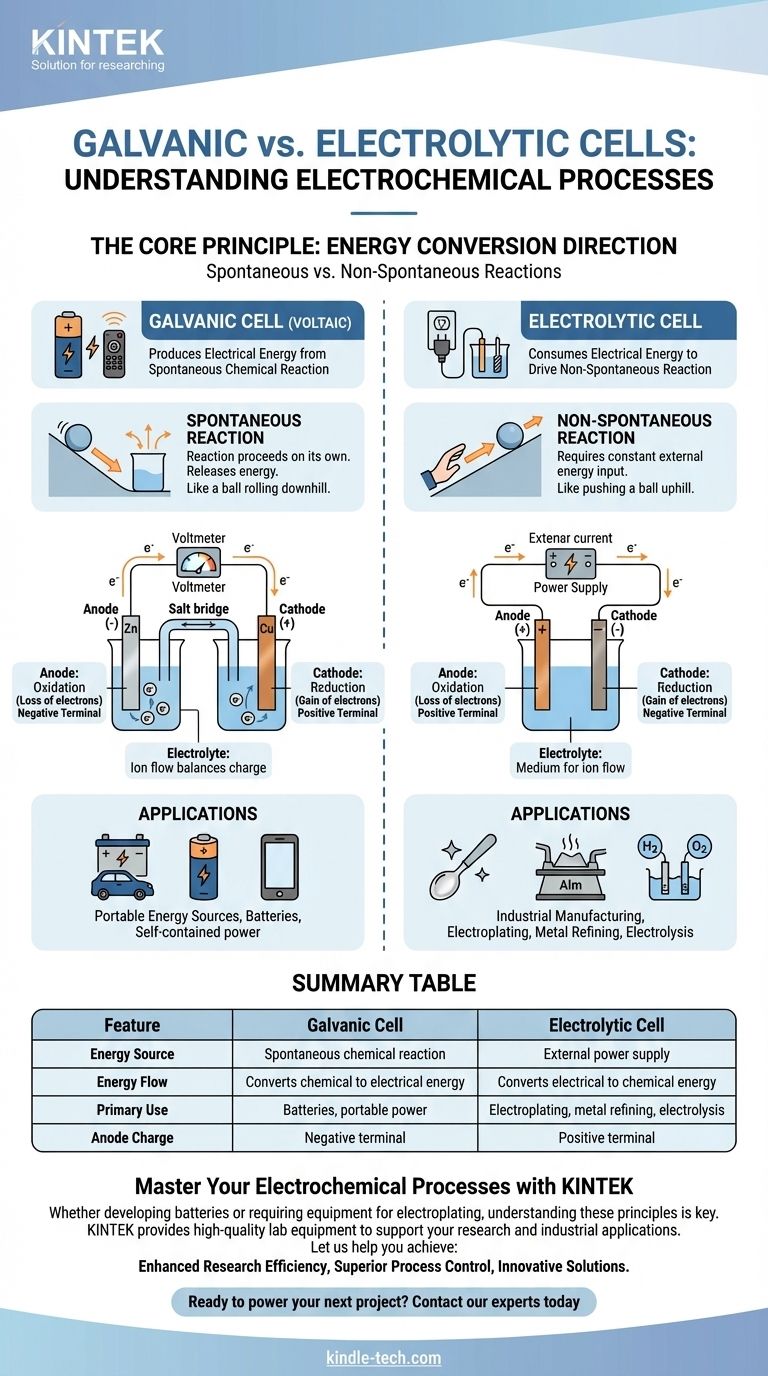
En esencia, una celda galvánica es una celda electroquímica que produce energía eléctrica a partir de una reacción química espontánea, como una batería que alimenta su control remoto. En contraste, una celda electrolítica consume energía eléctrica de una fuente externa para forzar una reacción química no espontánea, un proceso utilizado en el recubrimiento y purificación de metales.
La distinción fundamental es la dirección de la conversión de energía. Una celda galvánica convierte la energía química almacenada en energía eléctrica, mientras que una celda electrolítica convierte la energía eléctrica externa en energía química.

El Principio Fundamental: Reacciones Espontáneas vs. No Espontáneas
El comportamiento de cualquier celda electroquímica está dictado por la tendencia natural de su reacción química. Esta tendencia es clave para entender por qué una celda produce energía y la otra la requiere.
Cómo las Celdas Galvánicas Generan Energía
Una celda galvánica, también conocida como celda voltaica, se construye en torno a una reacción química espontánea.
Esta es una reacción que procede por sí misma sin intervención externa, liberando energía en el proceso. Piense en ello como una pelota rodando cuesta abajo.
Esta liberación de energía empuja los electrones a través de un circuito externo, creando una corriente eléctrica. Este es el principio detrás de todas las baterías no recargables y las baterías recargables que se descargan.
Cómo las Celdas Electrolíticas Consumen Energía
Una celda electrolítica impulsa una reacción química no espontánea.
Esta es una reacción que no ocurrirá por sí sola y requiere un aporte constante de energía para proceder. Es el equivalente a empujar una pelota cuesta arriba.
Una fuente de energía externa, como una fuente de alimentación, proporciona el voltaje necesario para forzar a los electrones a fluir en contra de su dirección natural, impulsando el cambio químico deseado.
Una Mirada Práctica a la Función de las Celdas
Aunque sus propósitos son opuestos, ambas celdas comparten componentes comunes que operan bajo las mismas reglas fundamentales de la química, pero con una diferencia crítica en la polaridad.
El Ánodo y el Cátodo: Una Historia de Dos Polaridades
En ambos tipos de celdas, el ánodo es siempre donde ocurre la oxidación (pérdida de electrones) y el cátodo es donde ocurre la reducción (ganancia de electrones).
Sin embargo, su carga eléctrica se invierte. En una celda galvánica, el ánodo es el terminal negativo porque la reacción espontánea libera electrones de él.
En una celda electrolítica, el ánodo es el terminal positivo porque la fuente de energía externa extrae electrones de él, forzando que ocurra la oxidación.
El Papel del Electrolito
Ambas celdas contienen un electrolito, típicamente una solución que contiene iones.
Este medio es esencial para completar el circuito eléctrico. Mientras los electrones fluyen a través del cable externo, los iones fluyen a través del electrolito para equilibrar la carga en los electrodos.
Comprendiendo las Aplicaciones y las Ventajas y Desventajas
Las funciones opuestas de estas celdas conducen a aplicaciones en el mundo real y limitaciones inherentes muy diferentes.
Celdas Galvánicas: Fuentes de Energía Portátiles
El uso principal de las celdas galvánicas es actuar como baterías. Proporcionan una fuente de energía eléctrica portátil y autónoma.
La desventaja es que los reactivos químicos dentro de la celda son finitos. Una vez que se consumen, la celda deja de producir energía y debe desecharse o recargarse.
Celdas Electrolíticas: Fabricación Industrial y Purificación
Las celdas electrolíticas son los caballos de batalla de la industria, utilizadas para procesos que de otro modo serían químicamente imposibles o ineficientes.
Las aplicaciones clave incluyen la galvanoplastia (recubrimiento de un metal con otro), la refinación de metales como el aluminio y el cobre, y la electrólisis del agua para producir hidrógeno y oxígeno. Su principal limitación es el requisito de un suministro significativo y continuo de energía eléctrica externa.
Cómo Aplicar Este Conocimiento
Su elección entre estos conceptos depende completamente de si su objetivo es generar energía o inducir un cambio químico.
- Si su enfoque principal es generar electricidad a partir de una reacción química: Está trabajando con los principios de una celda galvánica, como al diseñar o comprender una batería.
- Si su enfoque principal es usar electricidad para crear un producto o refinar una sustancia: Está trabajando con los principios de una celda electrolítica, común en la fabricación química y la metalurgia.
Comprender esta división es el primer paso para dominar la aplicación práctica de la electroquímica.
Tabla Resumen:
| Característica | Celda Galvánica | Celda Electrolítica |
|---|---|---|
| Fuente de Energía | Reacción química espontánea | Fuente de alimentación externa |
| Flujo de Energía | Convierte energía química en eléctrica | Convierte energía eléctrica en química |
| Uso Principal | Baterías, energía portátil | Galvanoplastia, refinación de metales, electrólisis |
| Carga del Ánodo | Terminal negativo | Terminal positivo |
Domine sus Procesos Electroquímicos con KINTEK
Ya sea que esté desarrollando nuevas tecnologías de baterías o requiera equipos precisos para galvanoplastia y purificación de metales, comprender estos principios electroquímicos fundamentales es solo el comienzo. KINTEK se especializa en proporcionar equipos de laboratorio y consumibles de alta calidad para apoyar su investigación y aplicaciones industriales.
Permítanos ayudarle a lograr:
- Eficiencia de Investigación Mejorada: Con equipos confiables para probar y desarrollar sistemas galvánicos y electrolíticos.
- Control de Procesos Superior: Para resultados consistentes en galvanoplastia, electrólisis y síntesis de materiales.
- Soluciones Innovadoras: Adaptadas a las necesidades únicas de laboratorios e instalaciones de producción.
¿Listo para impulsar su próximo proyecto? Contacte a nuestros expertos hoy para encontrar la solución perfecta para sus necesidades de laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Cómo contribuye un sistema de protección de argón de alta pureza al proceso de síntesis electroquímica de sales fundidas? Garantizar la pureza de la fase del material
- ¿Para qué tipos de sistemas, rangos de temperatura y configuraciones de sellado está diseñada la celda espectroelectroquímica de capa delgada? Ideal para análisis acuosos y no acuosos
- ¿Cuáles son las condiciones de almacenamiento ideales para una celda electrolítica óptica de ventana lateral? Asegure la precisión y el rendimiento a largo plazo
- ¿Por qué es importante el control de voltaje y cuáles son los riesgos? Garantice la seguridad y la longevidad de sus sistemas electroquímicos
- ¿Cuál es el papel de una membrana de intercambio iónico en la electrólisis Kolbe de MCCA? Mejore la pureza y la seguridad en su laboratorio
- ¿Por qué es necesario un sistema de celda electroquímica de tres electrodos para la cinética de corrosión de aleaciones de Ni-Cr? Análisis de expertos
- ¿Cuál es la diferencia entre una celda galvánica y una celda electrolítica? Una guía para el flujo de energía en la electroquímica
- ¿Por qué se elige típicamente el acrílico (PMMA) para las celdas electrolíticas? Beneficios claros para el diseño electroquímico



















