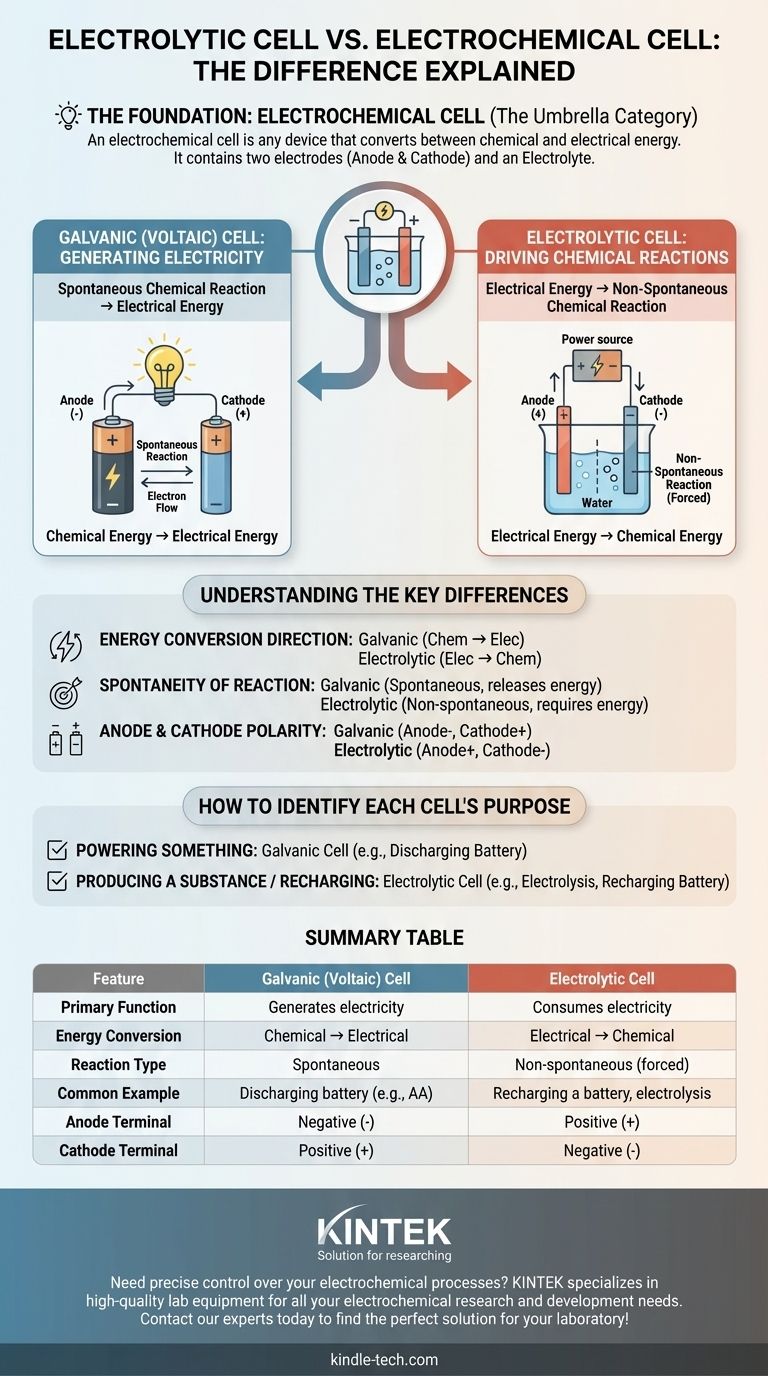
La principal fuente de confusión es que una celda electrolítica no es un concepto separado de una celda electroquímica, es uno de los dos tipos principales de celdas electroquímicas. Una celda electroquímica es la categoría amplia para cualquier dispositivo que convierte energía química en eléctrica y viceversa. La verdadera distinción radica entre las celdas galvánicas (voltaicas), que generan electricidad a partir de reacciones químicas, y las celdas electrolíticas, que utilizan electricidad para provocar reacciones químicas.
El término celda electroquímica es la categoría general. Los dos tipos específicos bajo este paraguas son las celdas galvánicas (que crean electricidad) y las celdas electrolíticas (que consumen electricidad). Su diferencia fundamental es la dirección de la conversión de energía.

La base: ¿Qué es una celda electroquímica?
Componentes principales
Una celda electroquímica es cualquier dispositivo que contiene dos electrodos (un ánodo y un cátodo) y un electrolito. Estos componentes trabajan juntos para facilitar la transferencia de electrones, ya sea creando o consumiendo una corriente eléctrica.
El propósito general
El único propósito de una celda electroquímica es servir como puente entre la energía química y la energía eléctrica. La dirección de esta conversión de energía determina el tipo específico de celda.
Los dos tipos fundamentales de conversión
Celdas galvánicas (voltaicas): Generación de electricidad
Una celda galvánica, también conocida como celda voltaica, aprovecha una reacción química espontánea para producir energía eléctrica.
Piense en una pila AA estándar. Los materiales químicos en su interior reaccionan naturalmente, liberando energía en forma de corriente eléctrica que puede alimentar un dispositivo. Esto es una celda galvánica en acción.
Celdas electrolíticas: Impulsando reacciones químicas
Una celda electrolítica hace exactamente lo contrario. Utiliza una fuente externa de energía eléctrica (como una fuente de alimentación) para forzar que ocurra una reacción química no espontánea.
Un ejemplo común es la electrólisis, como la división del agua en hidrógeno y oxígeno. Esta reacción no ocurre por sí sola; requiere una entrada constante de electricidad, que es la función de la celda electrolítica. Recargar una batería es otro ejemplo de este proceso.
Comprendiendo las diferencias clave
Dirección de la conversión de energía
Esta es la distinción más crítica. Una celda galvánica convierte la energía química almacenada en energía eléctrica. Una celda electrolítica convierte la energía eléctrica suministrada en energía química.
Espontaneidad de la reacción
La reacción química en una celda galvánica es espontánea, procede naturalmente y libera energía.
La reacción en una celda electrolítica es no espontánea, requiere una entrada constante de energía externa para proceder.
Polaridad del ánodo y el cátodo
Este es un punto común de confusión, pero sigue lógicamente el flujo de energía.
En una celda galvánica (batería descargándose), el ánodo es la fuente de electrones, lo que lo convierte en el terminal negativo, mientras que el cátodo es el terminal positivo.
En una celda electrolítica (batería recargándose), una fuente de energía externa invierte el flujo. El ánodo es donde aún ocurre la oxidación, pero se ve forzado a ser el terminal positivo, y el cátodo es el terminal negativo.
Cómo identificar el propósito de cada celda
Utilice la función principal de la celda como guía para distinguir fácilmente entre los dos tipos.
- Si el objetivo principal es alimentar algo: Está utilizando una celda galvánica (voltaica), ya que una reacción química espontánea está produciendo electricidad.
- Si el objetivo principal es producir una sustancia o recargar una batería: Está utilizando una celda electrolítica, ya que se está consumiendo electricidad para forzar una reacción química.
En última instancia, ambas son simplemente dos caras de la misma moneda electroquímica, definidas por si generan o consumen energía eléctrica.
Tabla resumen:
| Característica | Celda Galvánica (Voltaica) | Celda Electrolítica |
|---|---|---|
| Función principal | Genera electricidad | Consume electricidad |
| Conversión de energía | Química → Eléctrica | Eléctrica → Química |
| Tipo de reacción | Espontánea | No espontánea (forzada) |
| Ejemplo común | Batería descargándose (ej., AA) | Recarga de una batería, electrólisis |
| Terminal del ánodo | Negativo (-) | Positivo (+) |
| Terminal del cátodo | Positivo (+) | Negativo (-) |
¿Necesita un control preciso sobre sus procesos electroquímicos? KINTEK se especializa en equipos de laboratorio de alta calidad para todas sus necesidades de investigación y desarrollo electroquímico. Ya sea que esté desarrollando nuevas tecnologías de baterías o sintetizando materiales mediante electrólisis, nuestros instrumentos confiables garantizan resultados precisos y reproducibles. Contacte a nuestros expertos hoy para encontrar la solución perfecta para su laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Qué funcionalidad central proporciona una celda electroquímica de tres electrodos? Pruebas de corrosión de precisión para recubrimientos
- ¿Cuáles son los pasos para configurar y ejecutar un experimento con la celda electrolítica Raman in situ?
- ¿Cómo se debe almacenar la celda electrolítica tipo H cuando no está en uso? Guía experta de almacenamiento y mantenimiento
- ¿Por qué se utiliza una celda electrolítica de cuarzo para aguas residuales de ácido acrílico? Garantizar la estabilidad química y la integridad de los datos
- ¿Cuáles son las ventajas de utilizar un electrolizador de brecha cero MEA en la electrólisis de CO2? Lograr alta eficiencia industrial
- ¿Cuál es la función de una membrana de intercambio de protones en una celda fotoelectroquímica (PEC) de reducción de dióxido de carbono?
- ¿Por qué utilizar agitación magnética en la electrodeposición de nano-plata? Lograr un tamaño y densidad de partícula uniformes
- ¿Cómo funciona la electrodeposición? Una guía para el recubrimiento de precisión con electricidad



















