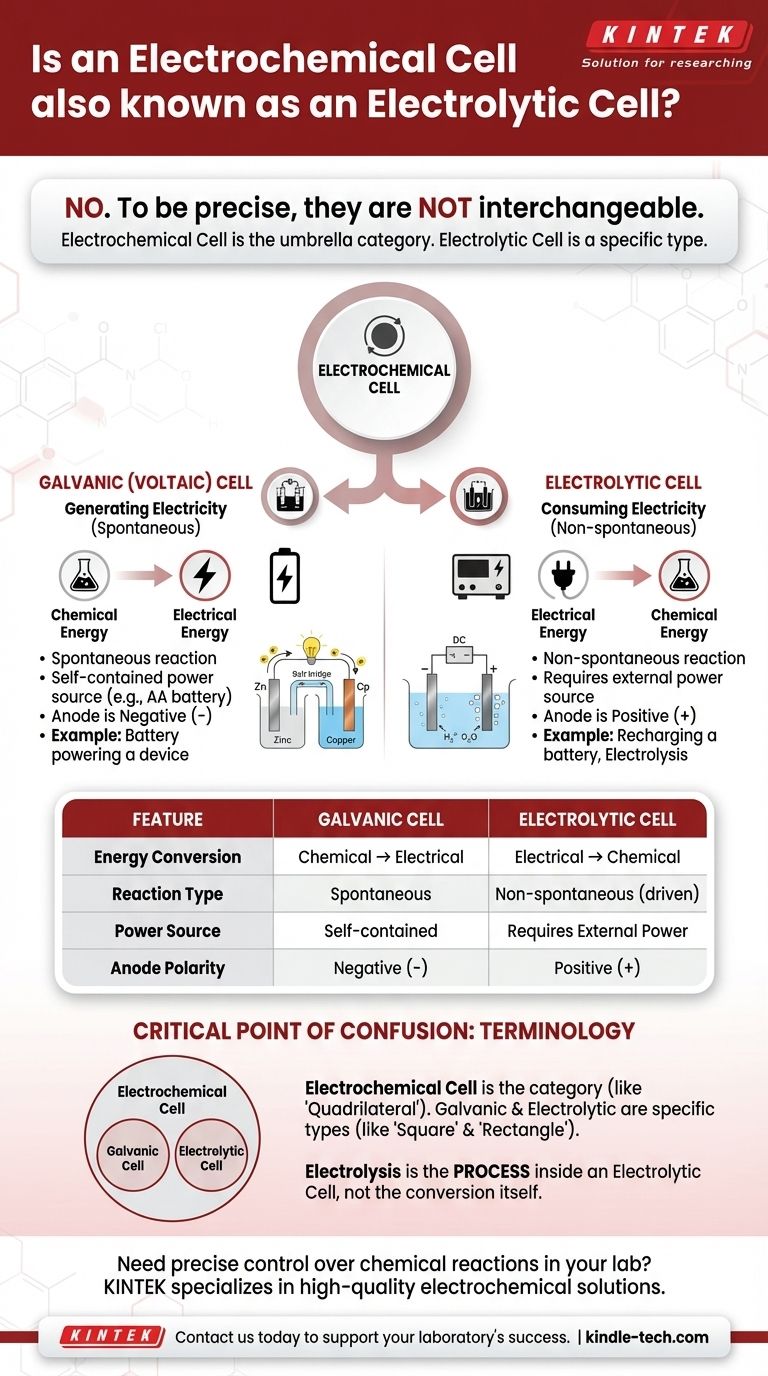
Para ser precisos, no. Una celda electrolítica es un tipo específico de celda electroquímica, pero los dos términos no son intercambiables. "Celda electroquímica" es la categoría amplia y general para cualquier dispositivo que convierte energía química en energía eléctrica o viceversa. Las celdas electrolíticas son el tipo que utiliza específicamente energía eléctrica para provocar una reacción química.
La distinción central se reduce a la dirección de la conversión de energía. Una celda galvánica (o voltaica) libera energía espontáneamente de una reacción química para crear electricidad. Una celda electrolítica consume electricidad de una fuente externa para forzar que ocurra una reacción química.

La distinción fundamental: Flujo de energía
El propósito de una celda electroquímica dicta su clasificación. La pregunta principal a hacerse es si la celda está produciendo energía o consumiéndola.
Celdas galvánicas (voltaicas): Generación de electricidad
Una celda galvánica, también conocida como celda voltaica, aprovecha una reacción química espontánea.
Los reactivos dentro de la celda tienen una tendencia natural a reaccionar, liberando energía en el proceso. Esta energía se captura como corriente eléctrica.
Piense en una pila AA estándar en un control remoto. Es una celda galvánica, que convierte su energía química interna en la energía eléctrica necesaria para alimentar el control remoto.
Celdas electrolíticas: Consumo de electricidad
Una celda electrolítica utiliza una fuente externa de energía eléctrica (como una fuente de alimentación) para impulsar una reacción química no espontánea.
Sin esta energía externa, la reacción química no ocurriría por sí sola. La electricidad fuerza la reacción a proceder contra su tendencia natural.
Un ejemplo común es la electrólisis, como la división del agua en gas hidrógeno y oxígeno. Otro es la recarga de una batería de iones de litio; usted está utilizando electricidad para revertir la reacción de descarga y restaurar su potencial químico.
Identificadores clave para cada tipo de celda
Más allá de la dirección del flujo de energía, algunas características técnicas ayudan a diferenciar los dos tipos de celdas.
El papel de una fuente de energía externa
Este es el indicador más sencillo. Si un dispositivo es autónomo y actúa como fuente de energía, es una celda galvánica.
Si el dispositivo requiere estar conectado a una fuente de energía externa para funcionar, es una celda electrolítica.
Polaridad del ánodo y el cátodo
Si bien las definiciones de ánodo (donde ocurre la oxidación) y cátodo (donde ocurre la reducción) permanecen constantes, su carga eléctrica (polaridad) cambia entre los dos tipos de celdas.
En una celda galvánica, el ánodo es el terminal negativo (-) y el cátodo es el terminal positivo (+).
En una celda electrolítica, la fuente de energía externa invierte esto. El ánodo se convierte en el terminal positivo (+) y el cátodo se convierte en el terminal negativo (-).
El punto crítico de confusión: Terminología
La principal fuente de confusión proviene de la naturaleza superpuesta pero distinta de los términos. No diferenciarlos conduce a malentendidos fundamentales.
"Celda electroquímica" es el término paraguas
Piense en "celda electroquímica" como la categoría general, como "cuadrilátero".
Las celdas galvánicas y las celdas electrolíticas son los tipos específicos dentro de esa categoría, al igual que "cuadrado" y "rectángulo" son tipos específicos de cuadriláteros. Una celda electrolítica es siempre una celda electroquímica, pero no todas las celdas electroquímicas son electrolíticas.
El mal uso de "electrólisis"
La electrólisis es el proceso de usar electricidad para impulsar una reacción química. Este proceso tiene lugar dentro de una celda electrolítica.
Algunas definiciones afirman incorrectamente que la electrólisis es la conversión de energía química en eléctrica. Esto es lo contrario de la verdad. La electrólisis se trata fundamentalmente de usar electricidad para crear un cambio químico.
Haciendo la distinción correcta para su objetivo
Para aplicar este conocimiento correctamente, simplemente identifique la función principal del dispositivo que está analizando.
- Si su enfoque está en un dispositivo que alimenta algo (un control remoto, un teléfono, un reloj): Está tratando con una celda galvánica (voltaica), que convierte la energía química almacenada en electricidad.
- Si su enfoque está en un proceso que utiliza electricidad para crear una sustancia (recargar una batería, galvanizar metal, producir gas cloro): Está tratando con una celda electrolítica, que utiliza energía eléctrica para forzar un cambio químico.
- Si está describiendo el campo general o un dispositivo con doble capacidad (como una batería recargable): El término "celda electroquímica" es la elección correcta y más inclusiva.
Comprender la dirección de la conversión de energía es la clave para dominar este concepto fundamental en química e ingeniería.
Tabla resumen:
| Característica | Celda galvánica (voltaica) | Celda electrolítica |
|---|---|---|
| Conversión de energía | Química → Eléctrica | Eléctrica → Química |
| Tipo de reacción | Espontánea | No espontánea (impulsada) |
| Fuente de energía | Autónoma (ej., batería) | Requiere fuente de alimentación externa |
| Polaridad del ánodo | Terminal negativo (-) | Terminal positivo (+) |
| Ejemplo común | Pila AA en un control remoto | Recarga de una batería de iones de litio |
¿Necesita un control preciso sobre las reacciones químicas en su laboratorio? Comprender el tipo correcto de celda electroquímica es crucial para su investigación y procesos. En KINTEK, nos especializamos en proporcionar equipos y consumibles de laboratorio de alta calidad adaptados a sus necesidades electroquímicas específicas. Ya sea que trabaje con celdas galvánicas para la generación de energía o celdas electrolíticas para la síntesis, nuestras soluciones garantizan precisión y fiabilidad. Contáctenos hoy para discutir cómo podemos apoyar el éxito de su laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Cuáles son los componentes principales de un sistema de celda de electrólisis y sus funciones? Domina el núcleo de las reacciones químicas controladas
- ¿Cuál es el papel de un reactor de vidrio en la electrólisis del agua alcalina? Garantizar la seguridad y la precisión visual
- ¿Por qué se utiliza un sistema de celda electroquímica de tres electrodos a temperatura constante en la electrodeposición de manganeso?
- ¿Qué papel juegan los electrolizadores de sales fundidas en la síntesis de amoníaco? Impulsando el ciclo mediado por litio
- Ventajas del proceso de los reactores BDD no divididos para aguas residuales: simplicidad mecánica y eficiencia de doble oxidación
- ¿Por qué es importante el control de voltaje y cuáles son los riesgos? Garantice la seguridad y la longevidad de sus sistemas electroquímicos
- ¿Qué medidas de seguridad personal y ambiental se deben tomar al operar una celda de electrólisis? Una guía completa para una operación segura
- ¿Qué precauciones se deben tomar durante el almacenamiento de una celda electrolítica de PTFE puro? Evite la deformación permanente y la falla del sello



















