Sí, el electrodo de plata/cloruro de plata (Ag/AgCl) es uno de los electrodos de referencia más comunes y fiables utilizados en electroquímica. Proporciona un potencial estable y constante que actúa como un punto de comparación fijo, lo que le permite medir con precisión el potencial de otro electrodo (el electrodo de trabajo) dentro de una celda electroquímica. Esta estabilidad lo hace indispensable para aplicaciones que van desde la medición del pH hasta la voltamperometría cíclica.
La función principal de un electrodo de referencia es proporcionar una línea base de voltaje inmutable. El electrodo Ag/AgCl logra esto a través de un equilibrio químico específico y estable, lo que lo convierte en un estándar fiable y rentable en la electroquímica moderna.

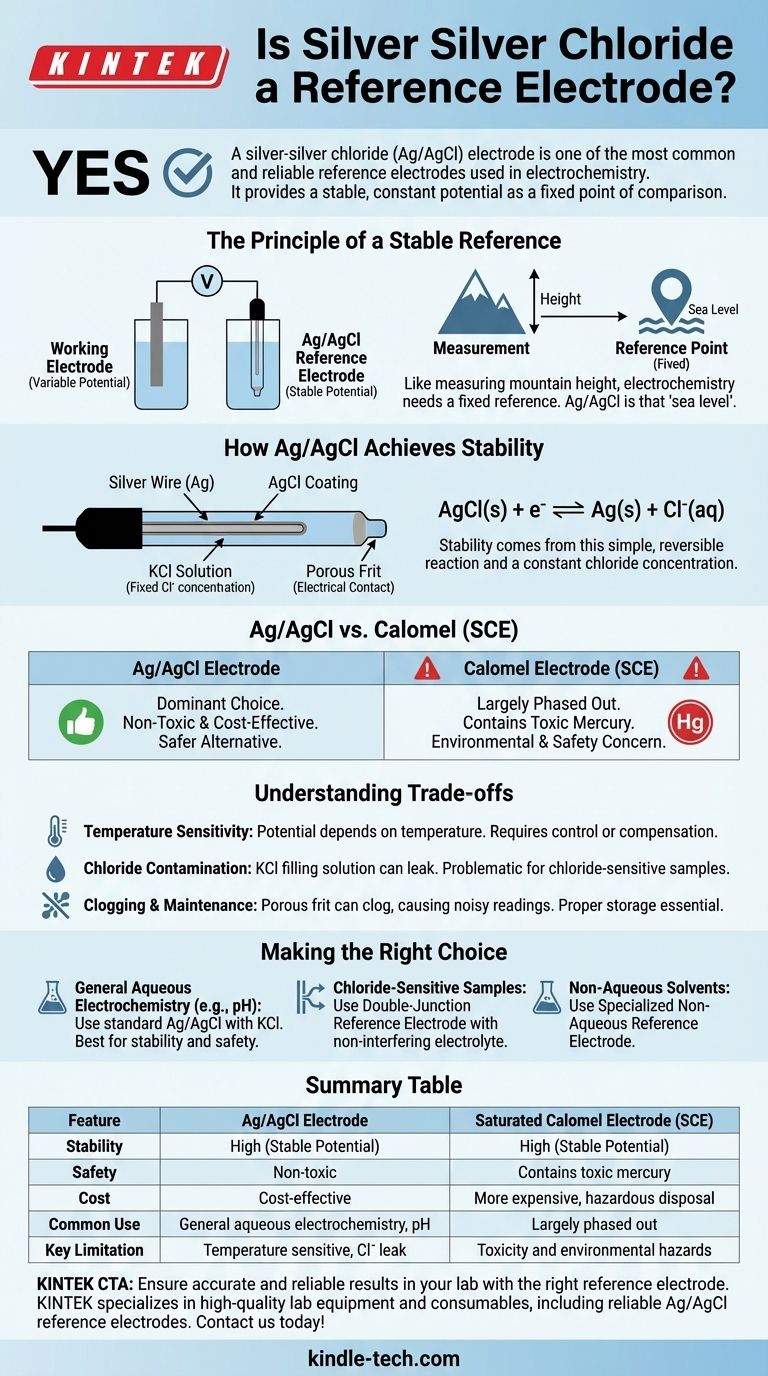
El principio de una referencia estable
Para comprender por qué el electrodo Ag/AgCl es tan eficaz, primero debemos entender qué constituye una buena referencia. Una medición electroquímica es siempre una comparación de potencial entre dos puntos.
¿Qué es un electrodo de referencia?
Un electrodo de referencia es una semicelda con un potencial de electrodo conocido y estable. Su trabajo es permanecer constante, independientemente de los cambios que ocurran en la otra mitad de la celda (el electrodo de trabajo y la solución de muestra).
Piense en ello como medir la altura de una montaña. Necesita un punto de referencia fijo, como el nivel del mar, para obtener una medición significativa. En electroquímica, el electrodo de referencia es el nivel del mar.
Cómo el Ag/AgCl logra la estabilidad
La estabilidad del electrodo Ag/AgCl proviene de una reacción química simple y reversible. Consiste en un alambre de plata recubierto con una fina capa de cloruro de plata (AgCl), todo inmerso en una solución con una concentración fija de iones cloruro ($\text{Cl}^-$), típicamente cloruro de potasio ($\text{KCl}$).
El potencial se establece mediante el equilibrio entre la plata metálica sólida y su sal:
$\text{AgCl}(\text{s}) + \text{e}^- \rightleftharpoons \text{Ag}(\text{s}) + \text{Cl}^-(\text{aq})$
Debido a que la concentración de la solución de cloruro dentro del electrodo se mantiene constante, el potencial de esta semirreacción permanece excepcionalmente estable.
Ag/AgCl frente a otros electrodos de referencia
El electrodo Ag/AgCl no es la única opción, pero sus ventajas lo han convertido en una opción dominante frente a estándares más antiguos como el Electrodo Calomel Saturado (SCE).
El auge del Ag/AgCl
La razón principal de la adopción generalizada del Ag/AgCl es su seguridad y rendimiento. Es relativamente económico de producir y, lo que es más importante, no es tóxico.
La decadencia del electrodo de calomel (SCE)
El electrodo de calomel, que utiliza una pasta de mercurio/cloruro de mercurioso, fue una vez un estándar común. Sin embargo, ha sido eliminado en gran medida en muchos laboratorios.
La razón clave es la toxicidad. El mercurio es un material peligroso, lo que hace que el uso, almacenamiento y eliminación de los electrodos de calomel sean una preocupación significativa para la seguridad y el medio ambiente.
Comprender las compensaciones
Aunque el electrodo Ag/AgCl es una excelente opción para uso general, no está exento de limitaciones. Comprender estas compensaciones es crucial para mediciones precisas.
Sensibilidad a la temperatura
El potencial de un electrodo Ag/AgCl depende de la temperatura. Para trabajos de alta precisión, la temperatura de la celda debe controlarse e informarse, o se debe utilizar una sonda de compensación de temperatura.
Contaminación por cloruro
El electrodo se llena con una solución concentrada de $\text{KCl}$. Una pequeña cantidad de esta solución puede filtrarse a través del frit poroso en la punta del electrodo hacia su muestra. Si su experimento es sensible a los iones cloruro, esta puede ser una fuente de error.
Obstrucción y mantenimiento
El frit poroso que permite el contacto eléctrico con la muestra puede obstruirse, lo que provoca lecturas de potencial ruidosas o fluctuantes. El almacenamiento adecuado (con la punta sumergida en su solución de relleno) y el mantenimiento regular son esenciales para una larga vida útil y resultados precisos.
Tomar la decisión correcta para su aplicación
Seleccionar el electrodo de referencia y la solución de relleno correctos es fundamental para el éxito experimental. Su elección depende completamente de la química de su muestra.
- Si está realizando electroquímica acuosa general (como la mayoría de las mediciones de pH o iones): Un electrodo Ag/AgCl con una solución de relleno estándar de $\text{KCl}$ es casi siempre la mejor opción debido a su estabilidad y seguridad.
- Si su muestra reacciona o es sensible a los iones cloruro: Debe utilizar un electrodo de referencia de "doble unión", donde una cámara exterior con un electrolito no interviniente (como nitrato de potasio) aísla el elemento interno Ag/AgCl de su muestra.
- Si está trabajando en disolventes no acuosos: Necesitará un electrodo de referencia no acuoso especializado, ya que los electrodos acuosos estándar no funcionarán correctamente y contaminarán su disolvente.
En última instancia, elegir el electrodo de referencia correcto consiste en garantizar que siga siendo un observador inerte y estable de la reacción química que desea estudiar.
Tabla de resumen:
| Característica | Electrodo Ag/AgCl | Electrodo Calomel Saturado (SCE) |
|---|---|---|
| Estabilidad | Alta (potencial estable) | Alta (potencial estable) |
| Seguridad | No tóxico | Contiene mercurio tóxico |
| Costo | Rentable | Más caro, eliminación peligrosa |
| Uso común | Electroquímica acuosa general, medición de pH | Eliminado en gran medida debido a problemas de seguridad |
| Limitación clave | Sensible a la temperatura, posible contaminación por cloruro | Toxicidad y peligros ambientales |
Asegure resultados precisos y fiables en su laboratorio con el electrodo de referencia adecuado. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluidos electrodos de referencia Ag/AgCl fiables adaptados a sus aplicaciones electroquímicas. Nuestros expertos pueden ayudarle a seleccionar el electrodo perfecto para mantener la estabilidad y evitar la contaminación en sus experimentos. Contáctenos hoy para mejorar la precisión y seguridad de su laboratorio.
Guía Visual
Productos relacionados
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo Electroquímico de Disco Metálico
- Electrodo de Disco de Oro
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo Electrolítico de Grafito en Disco y Varilla de Grafito
La gente también pregunta
- ¿Cómo debe almacenarse un electrodo de carbono vítreo durante largos períodos de inactividad? Asegure el máximo rendimiento y longevidad
- ¿Qué factores ambientales deben controlarse al usar un electrodo de varilla/hilo de platino? Asegure mediciones electroquímicas precisas
- ¿Cuáles son las características del Electrodo Funcional de Platino-Titanio? Desbloquee un Rendimiento Electroquímico Superior
- ¿De qué material está hecho un electrodo de disco de platino? La guía definitiva de materiales para electrodos
- ¿Por qué se utiliza un disco de carbono vítreo pulido como sustrato del electrodo de trabajo? Garantice la precisión en el grabado electroquímico
- ¿Qué pasos de preparación se requieren para los electrodos? Asegure un análisis electroquímico de alta precisión
- ¿Cuáles son las características clave de rendimiento y las aplicaciones de las láminas de oro? Desbloquee la máxima fiabilidad para aplicaciones críticas
- ¿Por qué es fundamental la selección del material del electrodo para la degradación de PFAS? Logre una mineralización del 100 % con la tecnología BDD

















