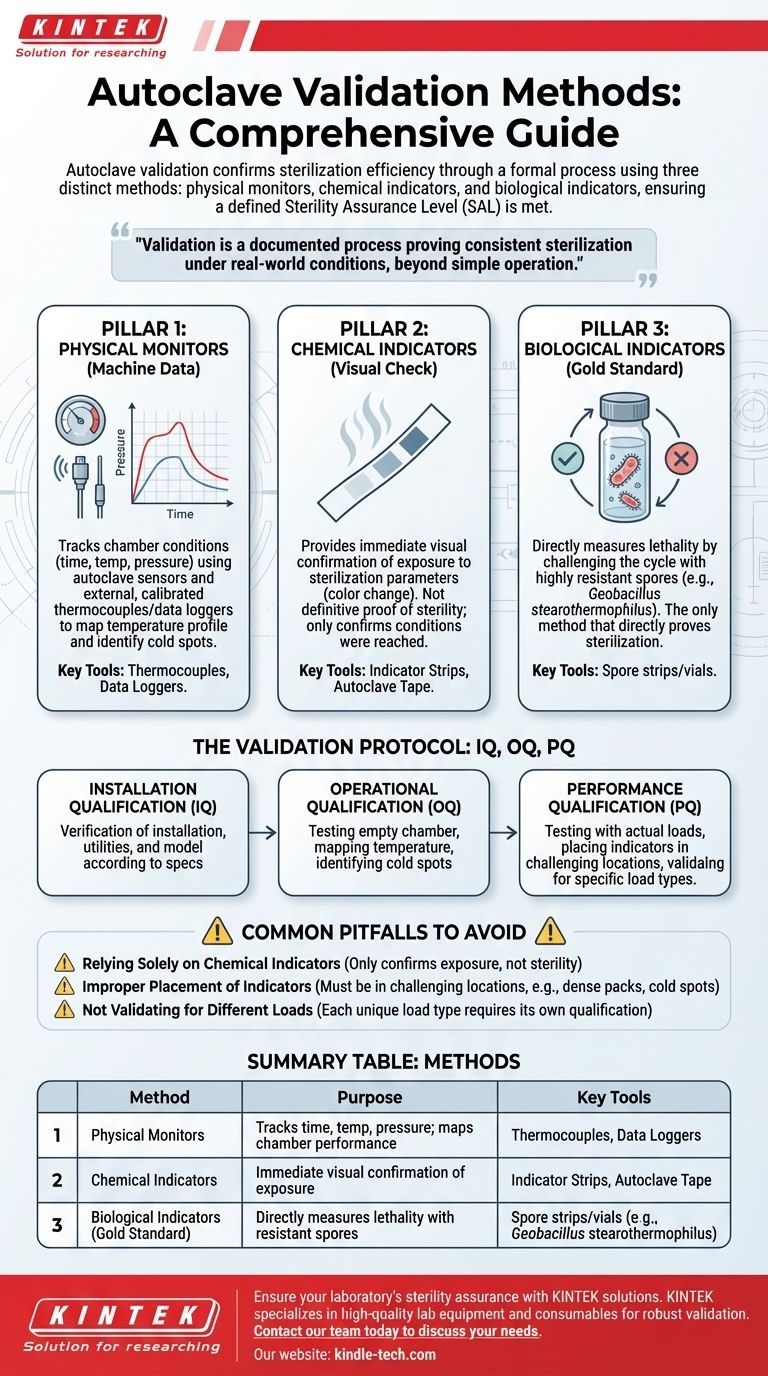
En resumen, la validación del autoclave se realiza utilizando una combinación de tres métodos distintos: monitores físicos, indicadores químicos e indicadores biológicos. Estos métodos se utilizan juntos en un proceso estructurado para proporcionar una confirmación completa y fiable de que el autoclave está alcanzando el nivel de esterilidad requerido.
La validación del autoclave no es una acción única, sino un proceso formal y documentado que prueba que el equipo esteriliza constantemente su contenido en condiciones del mundo real. Va más allá de simplemente operar la máquina para proporcionar evidencia objetiva de que se ha alcanzado un Nivel de Garantía de Esterilidad (SAL) definido.

Los tres pilares de la validación del autoclave
La verdadera validación se basa en un enfoque multifacético. Cada método proporciona una pieza diferente del rompecabezas, y solo cuando se usan juntos ofrecen una imagen completa del rendimiento del autoclave.
Pilar 1: Monitores físicos (datos de la máquina)
Los monitores físicos son los sensores y registradores de datos que rastrean las condiciones físicas dentro de la cámara del autoclave durante un ciclo.
Estos incluyen las propias sondas de temperatura del autoclave, los sensores de presión y los temporizadores. Para una validación formal, se colocan termopares y registradores de datos externos y calibrados en toda la cámara para mapear su perfil de temperatura e identificar cualquier "punto frío".
Este método proporciona un registro preciso y con marca de tiempo de los parámetros físicos del ciclo, confirmando si se alcanzó y mantuvo la temperatura y presión objetivo durante la duración requerida.
Pilar 2: Indicadores químicos (la verificación visual)
Los indicadores químicos son materiales que experimentan un cambio visible, típicamente de color, cuando se exponen a uno o más parámetros de esterilización específicos como la temperatura o el vapor.
Estos se ven con mayor frecuencia como tiras o cinta indicadora. Proporcionan una confirmación visual rápida de que los elementos dentro del autoclave han sido expuestos al proceso de esterilización.
Sin embargo, no son una prueba definitiva de esterilidad. Un indicador químico que cambia de color solo confirma que se alcanzó una cierta temperatura, no que se mantuvo el tiempo suficiente o que el vapor penetró la carga de manera efectiva para matar los microorganismos.
Pilar 3: Indicadores biológicos (el estándar de oro)
Los indicadores biológicos (BI) son la herramienta más crítica para la validación, ya que miden directamente la letalidad del proceso de esterilización.
Los BI consisten en una población estandarizada de esporas bacterianas altamente resistentes, la más común es Geobacillus stearothermophilus. Se sabe que estas esporas son mucho más difíciles de matar que los microorganismos comunes que se encuentran en un laboratorio.
Después de un ciclo, el BI se incuba. Si no hay crecimiento, proporciona un alto grado de confianza de que todas las demás posibles cargas biológicas en la carga han sido destruidas con éxito. Este es el único método que prueba directamente que se logró la esterilización.
Uniendo las piezas: el protocolo de validación
Estos tres pilares se integran en un proceso de calificación formal, que a menudo se divide en tres fases conocidas como CI, CO y CP.
Calificación de instalación (CI)
Esta es la verificación documentada inicial. Verifica que el autoclave sea el modelo correcto, que se haya instalado correctamente de acuerdo con las especificaciones del fabricante y que todos los servicios públicos necesarios (energía, agua) estén conectados correctamente.
Calificación operativa (CO)
En la CO, el autoclave se prueba para confirmar que funciona correctamente vacío. Esta fase implica mapear la temperatura de la cámara con múltiples termopares para asegurar que el calor se distribuya uniformemente y para identificar las ubicaciones más frías dentro de la cámara.
Calificación de rendimiento (CP)
Esta es la fase más crucial. El autoclave se prueba con cargas reales que representan los materiales que se esterilizarán diariamente (por ejemplo, líquidos, instrumentos, bolsas de residuos).
Durante la CP, tanto los indicadores químicos como los biológicos se colocan estratégicamente en toda la carga, con un enfoque especial en los "puntos fríos" identificados durante la CO. Las ejecuciones exitosas de la CP demuestran que el autoclave puede esterilizar eficazmente su contenido previsto en condiciones del mundo real.
Errores comunes a evitar
Lograr una validación confiable significa ser consciente de los errores comunes que pueden llevar a una falsa sensación de seguridad.
Confiar únicamente en indicadores químicos
El error más frecuente es asumir que un cambio de color en la cinta indicadora equivale a esterilidad. No es así. Los indicadores químicos solo confirman la exposición al calor y deben usarse para el monitoreo rutinario, no como la única base para la validación.
Colocación incorrecta de los indicadores
Colocar los BI en un área abierta y de fácil acceso de la cámara no es una prueba válida. Deben colocarse en los lugares más difíciles para que el vapor penetre: dentro de paquetes densos, dentro de recipientes de líquidos o en los puntos fríos identificados.
No validar para diferentes cargas
Un ciclo de esterilización que funciona para una bandeja de cristalería puede fallar para un matraz grande de medios líquidos. Cada tipo y configuración de carga única requiere su propia calificación de rendimiento para garantizar que pueda esterilizarse de manera confiable.
Tomar la decisión correcta para su objetivo
Su enfoque de validación debe coincidir con sus necesidades operativas específicas y los requisitos reglamentarios.
- Si su enfoque principal son las verificaciones operativas rutinarias: Use un indicador químico en cada carga para una confirmación visual inmediata, y realice una prueba con un indicador biológico con una frecuencia establecida (por ejemplo, semanal o mensual) para verificar el rendimiento continuo.
- Si su enfoque principal es la calificación inicial o la validación posterior a la reparación: Debe realizar un protocolo completo de CI, CO y CP utilizando termopares externos e indicadores biológicos colocados estratégicamente para documentar formalmente la capacidad de la máquina.
- Si su enfoque principal es el cumplimiento de GxP o normativo: Documente meticulosamente todos los resultados de CI, CO y CP para cada tipo de carga, establezca un programa recurrente de recalificación y tenga un protocolo claro para investigar cualquier falla de BI.
En última instancia, una validación sólida es la base de la confianza, asegurando que cada ciclo brinde la esterilidad de la que depende su trabajo.
Tabla resumen:
| Método | Propósito | Herramientas clave |
|---|---|---|
| Monitores físicos | Rastrea el tiempo, la temperatura y la presión; mapea el rendimiento de la cámara. | Termopares, registradores de datos |
| Indicadores químicos | Proporciona confirmación visual inmediata de la exposición al calor/vapor. | Tiras indicadoras, cinta de autoclave |
| Indicadores biológicos (estándar de oro) | Mide directamente la letalidad desafiando el ciclo con esporas resistentes. | Tiras/viales de esporas (por ejemplo, Geobacillus stearothermophilus) |
Asegure la esterilidad de su laboratorio con las soluciones KINTEK.
La validación adecuada del autoclave es fundamental para la integridad de su investigación, diagnósticos y producción. KINTEK se especializa en proporcionar equipos de laboratorio y consumibles de alta calidad, desde autoclaves confiables hasta indicadores biológicos certificados, de los que dependen sus protocolos de validación.
Deje que nuestros expertos le ayuden a construir un programa sólido de validación y monitoreo adaptado a sus necesidades específicas y requisitos de cumplimiento.
Contacte a nuestro equipo hoy para discutir sus necesidades de validación de autoclaves y garantía de esterilidad.
Guía Visual
Productos relacionados
- Autoclave de laboratorio esterilizador automático de pantalla digital portátil para presión de esterilización
- Esterilizador de autoclave de laboratorio rápido de escritorio de 35L 50L 90L para uso en laboratorio
- Autoclave de laboratorio portátil de alta presión esterilizador de vapor para uso en laboratorio
- Autoclave de vapor de alta presión de laboratorio vertical para departamento de laboratorio
- Esterilizador de Laboratorio Autoclave de Vacío Pulsante Esterilizador de Vapor de Escritorio
La gente también pregunta
- ¿Qué papel juega un autoclave de laboratorio en la separación de la lignina? Extracción de alta pureza para la investigación de biomasa
- ¿Cuáles son los parámetros operativos estándar para un autoclave? Dominio de la temperatura, la presión y el tiempo para la esterilización
- ¿Qué condiciones extremas simula un autoclave de laboratorio? Pruebas de resistencia al desgaste del revestimiento de combustible nuclear
- ¿Cuáles son las ventajas de utilizar un autoclave equipado con un dispositivo de agitación para pruebas de sales fundidas? Precisión Dinámica
- ¿Cuál es la función de los autoclaves de laboratorio en la investigación de SCWR? Predicción de la compatibilidad de materiales y la cinética de la corrosión














