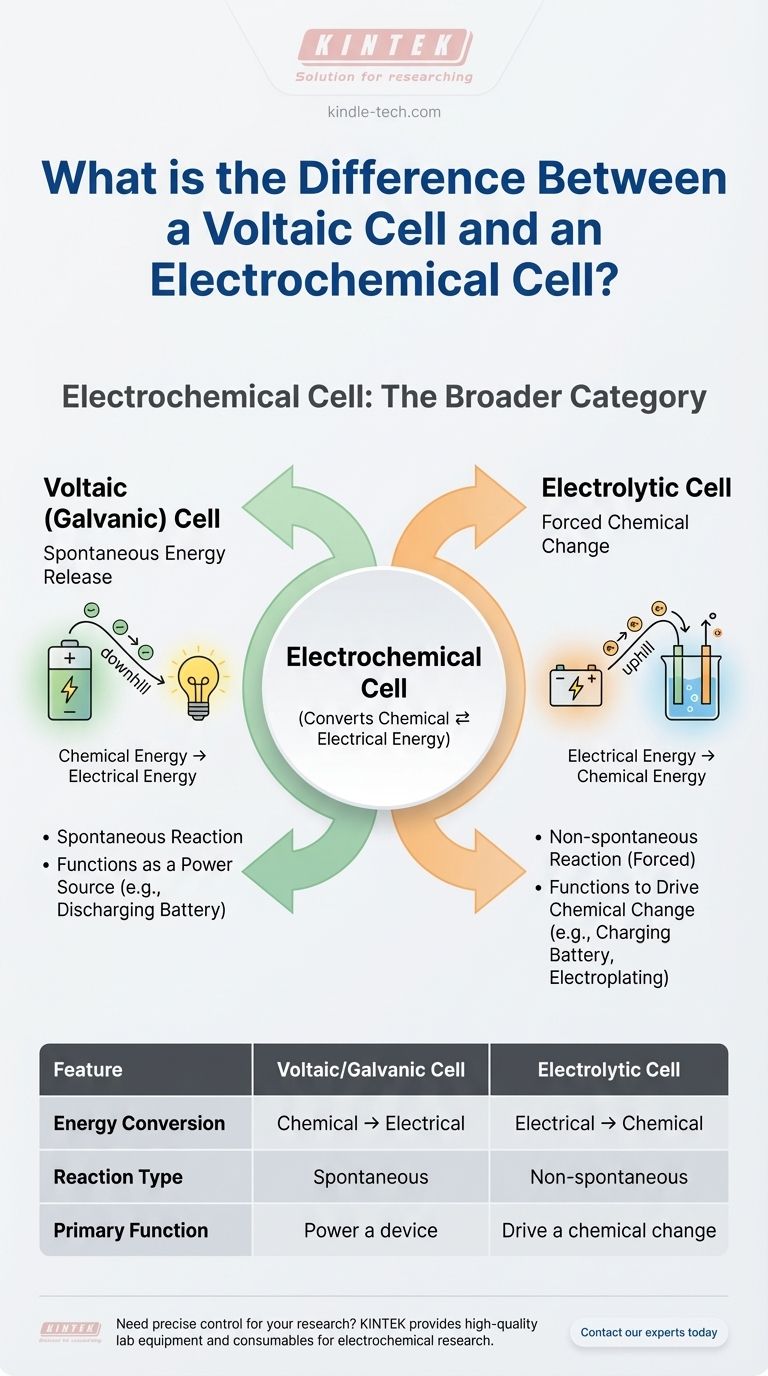
Para ser directos, una pila voltaica no es diferente de una celda electroquímica, es un tipo de celda electroquímica. El término "celda electroquímica" es la categoría amplia para cualquier dispositivo que convierte energía química en energía eléctrica o viceversa. Una pila voltaica, también conocida como celda galvánica, es el tipo específico que genera electricidad espontáneamente a partir de una reacción química.
El malentendido central surge de tratar estos términos como opciones paralelas. En cambio, piénselo como una jerarquía: "Celda Electroquímica" es el nombre de la familia, y tiene dos hijos: la Pila Voltaica (que produce energía) y la Celda Electrolítica (que consume energía).

Las Dos Vías de la Electroquímica
Una celda electroquímica es fundamentalmente un puente entre el mundo químico y el eléctrico. Todas estas celdas comparten componentes básicos: dos electrodos (un ánodo y un cátodo) y un electrolito que permite que los iones se muevan entre ellos.
La diferencia crucial radica en la dirección de la conversión de energía.
Tipo 1: La Pila Voltaica (Galvánica) — Liberación Espontánea de Energía
Una pila voltaica aprovecha una reacción química espontánea para producir energía eléctrica.
Piense en ello como un tobogán controlado. Los químicos están naturalmente "cuesta abajo" en términos de energía, y la pila voltaica proporciona un camino para que esa energía se libere como una corriente eléctrica útil.
Este es el principio detrás de una batería común. Las reacciones químicas dentro de una pila AA quieren ocurrir por sí solas, y cuando se completa el circuito, la pila canaliza el flujo resultante de electrones para alimentar su dispositivo.
Tipo 2: La Celda Electrolítica — Cambio Químico Forzado
Una celda electrolítica hace exactamente lo contrario. Utiliza una fuente externa de energía eléctrica para forzar una reacción química que no ocurriría por sí sola.
Este es el camino "cuesta arriba". Se está introduciendo energía en el sistema para crear un estado químico menos estable.
Ejemplos clásicos incluyen el uso de electricidad para la electrólisis (como la división del agua en hidrógeno y oxígeno) o la recarga de una batería. Cuando carga su teléfono, está haciendo funcionar su batería como una celda electrolítica, invirtiendo las reacciones químicas que ocurrieron cuando estaba alimentando su dispositivo.
Comprendiendo las Diferencias Críticas
La distinción entre estos dos tipos de celdas es el concepto más importante en la electroquímica básica. La dirección del flujo de energía dicta la función completa de la celda.
Conversión de Energía
Una pila voltaica convierte energía química en energía eléctrica. Es una fuente de energía.
Una celda electrolítica convierte energía eléctrica en energía química. Es un consumidor de energía.
Espontaneidad de la Reacción
La reacción redox en una pila voltaica es espontánea. Ocurre sin intervención externa una vez que el circuito está completo.
La reacción redox en una celda electrolítica es no espontánea. Requiere una fuente de energía externa (como una batería o una fuente de alimentación de CC) para proceder.
Función Práctica
La función de una pila voltaica es alimentar algo. Piense en cualquier batería estándar no recargable.
La función de una celda electrolítica es producir un cambio químico. Piense en la galvanoplastia de metal o la carga de una batería recargable.
Cómo Clasificar Correctamente Su Celda
Para aplicar este conocimiento, simplemente pregunte si la celda está produciendo energía o consumiéndola para impulsar una reacción.
- Si su enfoque principal es describir cualquier dispositivo que interconvierta energía química y eléctrica: Use el término amplio celda electroquímica.
- Si está describiendo específicamente una batería que se está descargando para alimentar un dispositivo: Use los términos específicos pila voltaica o celda galvánica.
- Si está describiendo específicamente un proceso que utiliza electricidad para forzar una reacción (como cargar una batería o electrólisis): Use el término específico celda electrolítica.
Al comprender esta sencilla clasificación, puede describir cualquier proceso electroquímico con precisión y claridad.
Tabla Resumen:
| Característica | Pila Voltaica/Galvánica | Celda Electrolítica |
|---|---|---|
| Conversión de Energía | Química → Eléctrica | Eléctrica → Química |
| Tipo de Reacción | Espontánea | No espontánea (Forzada) |
| Función Principal | Alimentar un dispositivo (ej., batería) | Impulsar un cambio químico (ej., galvanoplastia) |
¿Necesita un control preciso sobre sus procesos electroquímicos? KINTEK se especializa en equipos de laboratorio y consumibles de alta calidad para todas sus necesidades de investigación y desarrollo electroquímico. Ya sea que trabaje con pilas voltaicas, celdas electrolíticas o cualquier otra aplicación de laboratorio, nuestras soluciones garantizan precisión y confiabilidad. Contacte a nuestros expertos hoy para encontrar el equipo perfecto para su laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Qué características ópticas tiene la celda electrolítica tipo H? Ventanas de cuarzo de precisión para fotoelectroquímica
- ¿Cuál es la estructura de una celda electrolítica de membrana intercambiable tipo H? Una guía para la separación electroquímica precisa
- ¿Qué es una celda tipo H? Una guía sobre celdas electroquímicas divididas para experimentos precisos
- ¿Cómo se debe almacenar la celda electrolítica tipo H cuando no está en uso? Guía experta de almacenamiento y mantenimiento
- ¿Cuál es el sistema experimental típico utilizado con una celda electrolítica de doble capa con baño de agua? Logre un control electroquímico preciso



















