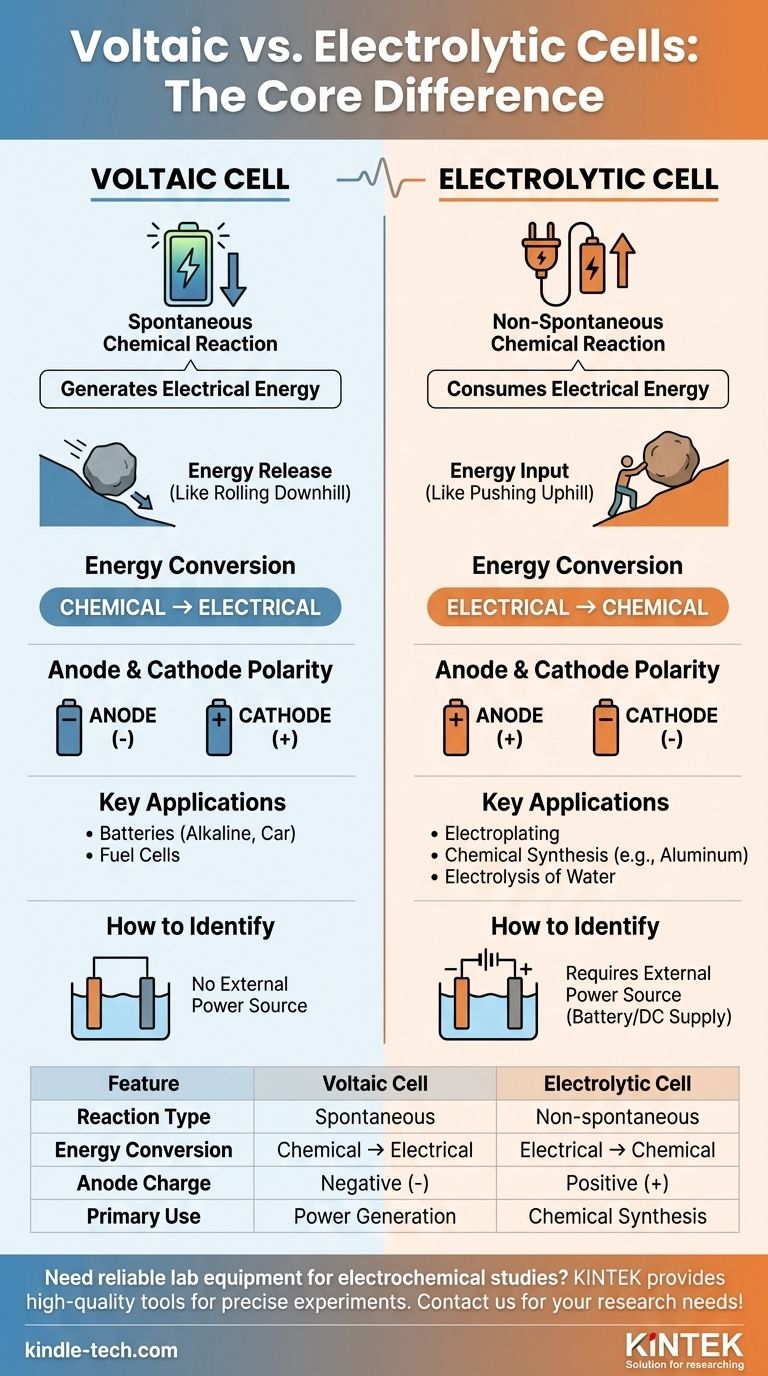
La diferencia principal entre una celda voltaica y una celda electrolítica radica en su propósito fundamental y la naturaleza de las reacciones químicas involucradas. Una celda voltaica, como una batería común, utiliza una reacción química espontánea para generar energía eléctrica. En contraste, una celda electrolítica utiliza energía eléctrica externa para impulsar una reacción química que no ocurriría por sí sola.
En esencia, la distinción se trata del flujo de energía. Una celda voltaica es una fuente de energía que libera energía de una reacción química dispuesta. Una celda electrolítica es un consumidor de energía que fuerza la ocurrencia de una reacción química no dispuesta.

El Principio Fundamental: Espontaneidad
El concepto más importante que separa estas dos celdas es si la reacción química es espontánea o no espontánea. Esto dicta toda la función y estructura de la celda.
Celdas Voltaicas: Liberación Espontánea de Energía
En una celda voltaica (también llamada celda galvánica), la reacción redox es espontánea. Los reactivos tienen una energía potencial química más alta que los productos.
Esta tendencia natural a reaccionar libera energía, que se aprovecha como corriente eléctrica. Piense en ello como una roca rodando cuesta abajo, sucede sin ningún empuje externo.
El potencial de celda estándar (E°celda) para una celda voltaica es siempre positivo, lo que indica una reacción espontánea.
Celdas Electrolíticas: Cambio Químico Forzado
En una celda electrolítica, la reacción redox es no espontánea. Los productos se encuentran en un estado de energía más alto que los reactivos.
Para que esta reacción ocurra, se debe aplicar una fuente de energía externa (como una batería o una fuente de CC). Esto es como empujar la roca cuesta arriba, requiere una entrada constante de energía.
El potencial de celda estándar (E°celda) para la reacción en una celda electrolítica es negativo, lo que confirma que no procederá sin ayuda externa.
Diferencias Funcionales y Estructurales Clave
La diferencia en la espontaneidad conduce a varias distinciones cruciales en cómo se construyen y cómo operan estas celdas.
Conversión de Energía
Una celda voltaica realiza la conversión de energía química a energía eléctrica. Es un generador de energía química.
Una celda electrolítica hace exactamente lo contrario. Convierte energía eléctrica en energía química, utilizando energía para crear nuevas sustancias.
Polaridad del Ánodo y Cátodo
Este es un punto frecuente de confusión, pero es simple si se recuerdan las definiciones básicas. En ambos tipos de celdas, la oxidación siempre ocurre en el ánodo y la reducción siempre ocurre en el cátodo.
Sin embargo, la carga de estos electrodos se invierte:
- En una celda voltaica, el ánodo es la fuente de electrones de la reacción espontánea, lo que lo convierte en el terminal negativo (-). El cátodo es donde se consumen los electrones, lo que lo convierte en el terminal positivo (+).
- En una celda electrolítica, la fuente de energía externa dicta la carga. Empuja los electrones hacia el cátodo, lo que lo convierte en el terminal negativo (-). Aleja los electrones del ánodo, lo que lo convierte en el terminal positivo (+).
Aplicaciones Prácticas
Las aplicaciones para cada tipo de celda reflejan directamente su función.
Las celdas voltaicas se utilizan para alimentar dispositivos. Los ejemplos incluyen baterías alcalinas cotidianas, baterías de automóvil (mientras se descargan) y celdas de combustible.
Las celdas electrolíticas se utilizan para síntesis y purificación. Las aplicaciones comunes incluyen el electrochapado de metales, la producción de aluminio puro y la electrólisis del agua para generar gas hidrógeno y oxígeno.
Errores Comunes y Distinciones Clave
Para evitar errores comunes, concéntrese en el propósito de la celda y la presencia de una fuente de energía externa.
Propósito: Energía vs. Producción
La forma más sencilla de distinguirlos es por su objetivo. ¿La celda está generando electricidad o está utilizando electricidad para producir una sustancia química? La primera es voltaica; la segunda es electrolítica.
El Papel del Puente Salino
Las celdas voltaicas a menudo consisten en dos semiceldas separadas conectadas por un puente salino. Este componente es crucial para mantener la neutralidad de la carga a medida que los iones fluyen durante la reacción espontánea.
Las celdas electrolíticas suelen ser más simples en su construcción, a menudo tienen lugar en un solo recipiente donde el propio electrolito permite el movimiento de iones.
La Fuente de Alimentación Externa
El indicador visual más claro en un diagrama es la presencia de una batería o fuente de alimentación. Si ve una conectada a los electrodos, está viendo una celda electrolítica. Su ausencia implica una celda voltaica.
Tomando la Decisión Correcta para su Objetivo
Para identificar el tipo de celda o comprender su función, considere el objetivo principal del sistema.
- Si su objetivo principal es alimentar un dispositivo: Está trabajando con una celda voltaica, que aprovecha una reacción química espontánea para producir una corriente.
- Si su objetivo principal es producir una sustancia pura (como gas cloro o metal cobre): Está utilizando una celda electrolítica, que impulsa una reacción no espontánea con una fuente de energía externa.
- Si está analizando un diagrama con una batería externa: Esto significa una celda electrolítica, ya que proporciona la energía necesaria para forzar el cambio químico.
Comprender esta división fundamental entre la generación espontánea y la reacción forzada es la clave para dominar la electroquímica.
Tabla Resumen:
| Característica | Celda Voltaica | Celda Electrolítica |
|---|---|---|
| Tipo de Reacción | Espontánea | No espontánea (requiere energía externa) |
| Conversión de Energía | Química → Eléctrica | Eléctrica → Química |
| Carga del Ánodo | Negativa (-) | Positiva (+) |
| Uso Principal | Generación de energía (ej., baterías) | Síntesis química (ej., electrochapado) |
¿Necesita equipo de laboratorio confiable para sus estudios electroquímicos? KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, proporcionando las herramientas precisas que necesita para experimentos que involucran celdas voltaicas y electrolíticas. Desde electrodos hasta fuentes de alimentación, nuestras soluciones ayudan a garantizar resultados precisos y reproducibles en su laboratorio. ¡Contáctenos hoy para encontrar el equipo perfecto para sus necesidades de investigación!
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Célula electrolítica electroquímica de cinco puertos
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
- Equipo de laboratorio de baterías Probador integral de capacidad y baterías
La gente también pregunta
- ¿Qué condiciones experimentales proporciona una celda electrolítica de tres electrodos? Optimice el análisis preciso de la corrosión
- ¿Cuáles son las características de diseño de una celda de prueba de visualización personalizada? Desbloquee información operativa de baterías
- ¿Qué papel juega una celda de prueba electroquímica controlada por presión en las pruebas de baterías de estado sólido?
- ¿Cuáles son las propiedades del material del cuerpo de la celda electrolítica de acrílico? | Claridad, seguridad y resistencia química
- ¿Cuáles son las limitaciones de resistencia al calor de los componentes de la celda? Evite fallas catastróficas en su laboratorio
- ¿Cuáles son las ventajas de utilizar una celda electrolítica indivisa para el Rojo Ácido-20? Aumentar la eficiencia y la velocidad
- ¿Cómo deben manipularse las celdas electrolíticas tipo H con componentes de vidrio? Una guía para un uso seguro y duradero
- ¿Cuál es el procedimiento de apagado correcto después de un experimento? Una guía paso a paso para la desactivación segura














