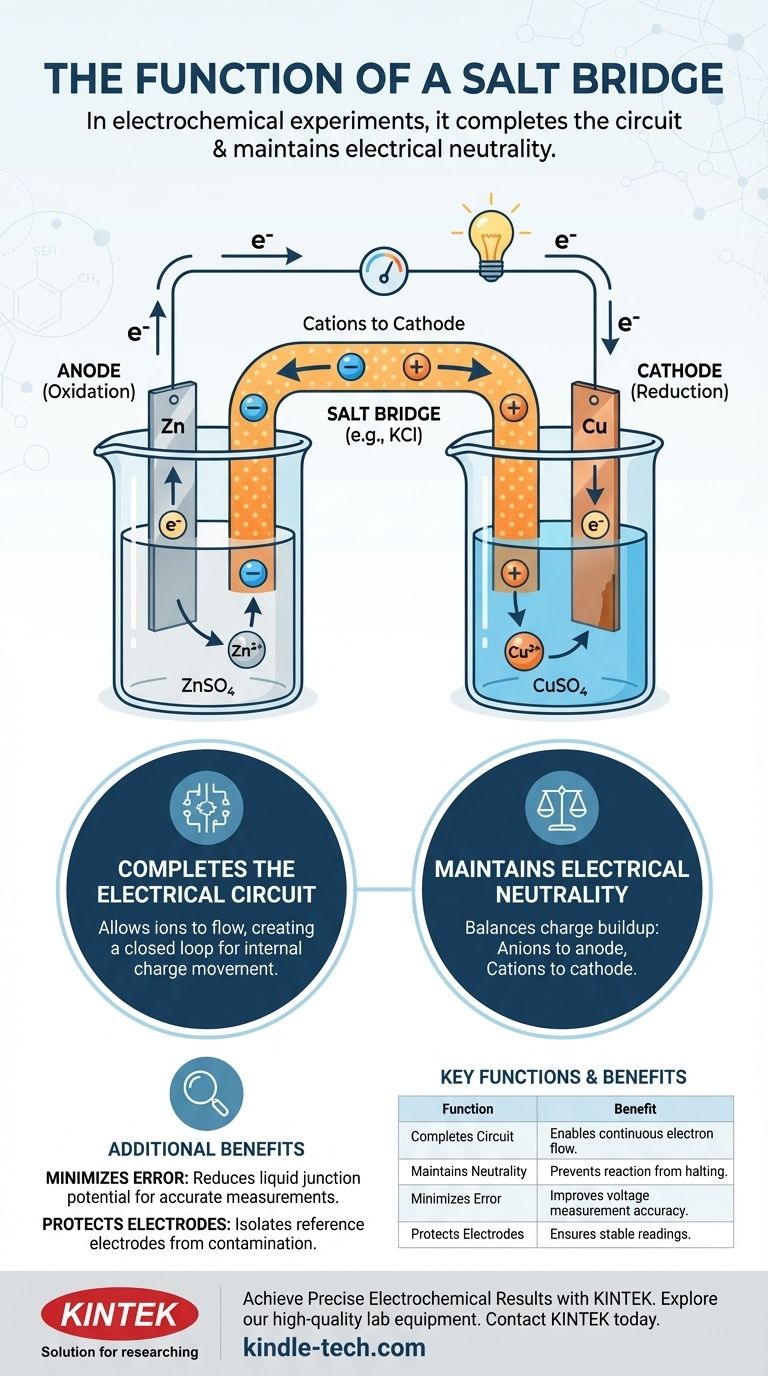
En experimentos electroquímicos, un puente salino cumple dos funciones principales: completa el circuito eléctrico al permitir que los iones fluyan entre las dos semiceldas, y mantiene la neutralidad eléctrica en cada semicelda. Sin este componente crucial, la carga se acumularía rápidamente, deteniendo el flujo de electrones y la reacción electroquímica casi instantáneamente.
Un puente salino no es solo un conector; es el mecanismo de equilibrio de carga que hace posible una reacción electroquímica sostenida. Funciona internamente, moviendo iones para contrarrestar el desequilibrio de carga creado por los electrones que se mueven externamente.

La anatomía de una celda electroquímica
Para comprender la función de un puente salino, primero debe visualizar el sistema dentro del cual opera. Una celda electroquímica es fundamentalmente un dispositivo que convierte energía química en energía eléctrica, o viceversa.
Las dos semiceldas
Una celda electroquímica está compuesta por dos semiceldas. Cada semicelda típicamente contiene un electrodo (un conductor sólido como zinc o cobre) sumergido en una solución electrolítica (una solución que contiene iones, como sulfato de zinc o sulfato de cobre).
En una semicelda, ocurre la oxidación (pérdida de electrones), y este electrodo se llama ánodo. En la otra, ocurre la reducción (ganancia de electrones), y este electrodo es el cátodo.
El problema: acumulación instantánea de carga
Los electrones generados en el ánodo viajan a través de un cable externo hacia el cátodo, creando una corriente eléctrica. Sin embargo, este flujo de electrones crea un problema inmediato.
A medida que el ánodo pierde electrones, su solución electrolítica acumula un exceso de iones positivos. Por el contrario, a medida que el cátodo gana electrones, su solución electrolítica desarrolla un exceso de iones negativos (a medida que se consumen los iones positivos de la solución). Esta separación de carga crea un potente voltaje opuesto que detiene por completo el flujo de electrones.
Las funciones principales de un puente salino
El puente salino es la solución elegante a este problema de acumulación de carga. Generalmente es un tubo en forma de U lleno con una solución concentrada de un electrolito inerte, como cloruro de potasio (KCl) o nitrato de potasio (KNO₃).
Completando el circuito eléctrico
Un circuito eléctrico completo requiere un bucle cerrado. El cable externo permite que los electrones fluyan, pero eso es solo la mitad del circuito. El puente salino completa el bucle al permitir que los iones fluyan entre las semiceldas, creando un camino para que la carga se mueva internamente.
Manteniendo la neutralidad eléctrica
Esta es la función más crítica del puente salino. Para neutralizar la carga acumulada:
- Los aniones (iones negativos) del puente salino migran hacia la semicelda del ánodo para equilibrar el exceso de iones positivos que se están creando.
- Los cationes (iones positivos) del puente salino migran hacia la semicelda del cátodo para equilibrar el exceso de carga negativa.
Al equilibrar constantemente la carga en ambas semiceldas, el puente salino asegura que la reacción electroquímica pueda continuar y que se pueda mantener una corriente constante.
Minimizar el potencial de unión líquida
En mediciones más precisas, el puente salino también sirve para reducir el potencial de unión líquida. Este es un voltaje pequeño e indeseado que se forma en la interfaz de dos soluciones electrolíticas diferentes. Al crear un puente iónico más gradual, minimiza esta fuente de error, lo que lleva a mediciones de potencial más precisas de la celda.
Comprendiendo las consideraciones prácticas
La efectividad de un puente salino depende completamente de su composición e interacción con el resto de la celda.
El electrolito debe ser inerte
Los iones dentro del puente salino no deben reaccionar con los iones en ninguna de las soluciones de las semiceldas. Por ejemplo, usar un puente salino de KCl en una celda que contenga nitrato de plata (AgNO₃) sería un error. Los iones cloruro (Cl⁻) reaccionarían con los iones plata (Ag⁺) para formar un precipitado sólido (AgCl), interrumpiendo la función de la celda.
Protección del electrodo de referencia
En una configuración de tres electrodos común en electroquímica, a menudo se utiliza un puente salino para conectar un electrodo de referencia (que tiene un potencial constante y conocido) a la solución principal. Esto se hace para aislar el electrodo de referencia, evitando que los iones de la solución de prueba lo contaminen y alteren su potencial estable. Esto prolonga la vida útil del electrodo y garantiza la precisión de la medición.
Tomando la decisión correcta para su experimento
El papel principal del puente salino es siempre facilitar el flujo de iones, pero su importancia puede verse a través de diferentes lentes según su objetivo.
- Si su enfoque principal es una simple demostración de celda galvánica: Piense en el puente salino como el componente que completa el circuito y permite que la batería funcione continuamente.
- Si su enfoque principal es la medición precisa de voltaje: El puente salino es fundamental para minimizar el potencial de unión líquida, que es una fuente clave de error experimental.
- Si su enfoque principal es la electroquímica analítica (por ejemplo, estudios de corrosión): El puente salino es esencial para aislar su electrodo de referencia y asegurar que tenga una línea de base estable y confiable para sus lecturas de potencial.
En última instancia, el puente salino permite el estudio controlado y continuo de las reacciones electroquímicas al resolver el problema fundamental de la separación de cargas.
Tabla resumen:
| Función | Descripción | Beneficio clave |
|---|---|---|
| Completa el circuito | Permite el flujo de iones entre las semiceldas. | Permite el flujo continuo de electrones. |
| Mantiene la neutralidad | Equilibra la acumulación de carga por transferencia de electrones. | Evita que la reacción se detenga. |
| Minimiza el error | Reduce el potencial de unión líquida. | Mejora la precisión de la medición de voltaje. |
| Protege los electrodos | Aísla los electrodos de referencia de la contaminación. | Garantiza lecturas estables y fiables. |
¿Listo para lograr resultados precisos y confiables en sus experimentos electroquímicos? El equipo adecuado es fundamental para su éxito. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluyendo celdas electroquímicas y accesorios diseñados para la precisión y durabilidad. Deje que nuestros expertos le ayuden a seleccionar la configuración perfecta para sus necesidades de investigación.
Contacte a KINTEK hoy mismo para discutir cómo podemos apoyar las capacidades electroquímicas de su laboratorio.
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Célula electrolítica electroquímica de cinco puertos
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Para qué tipo de sistema de electrodos está diseñada la celda electrolítica de evaluación de recubrimientos? Desbloquee el análisis preciso de recubrimientos
- ¿Cómo se utiliza una celda electrolítica de alta precisión para evaluar la resistencia a la corrosión de los metales? Valide los resultados de DCT con precisión
- ¿Cuál es el rango de volumen de la celda electrolítica de evaluación de recubrimientos? Una guía para elegir el tamaño adecuado
- ¿Cómo se utiliza una celda electrolítica electroquímica de tres electrodos para evaluar la resistencia a la corrosión de la aleación Zr-Nb?
- ¿Qué papel juega una celda electrolítica encamisada por agua en las mediciones de corrosión electroquímica a temperatura variable?


















