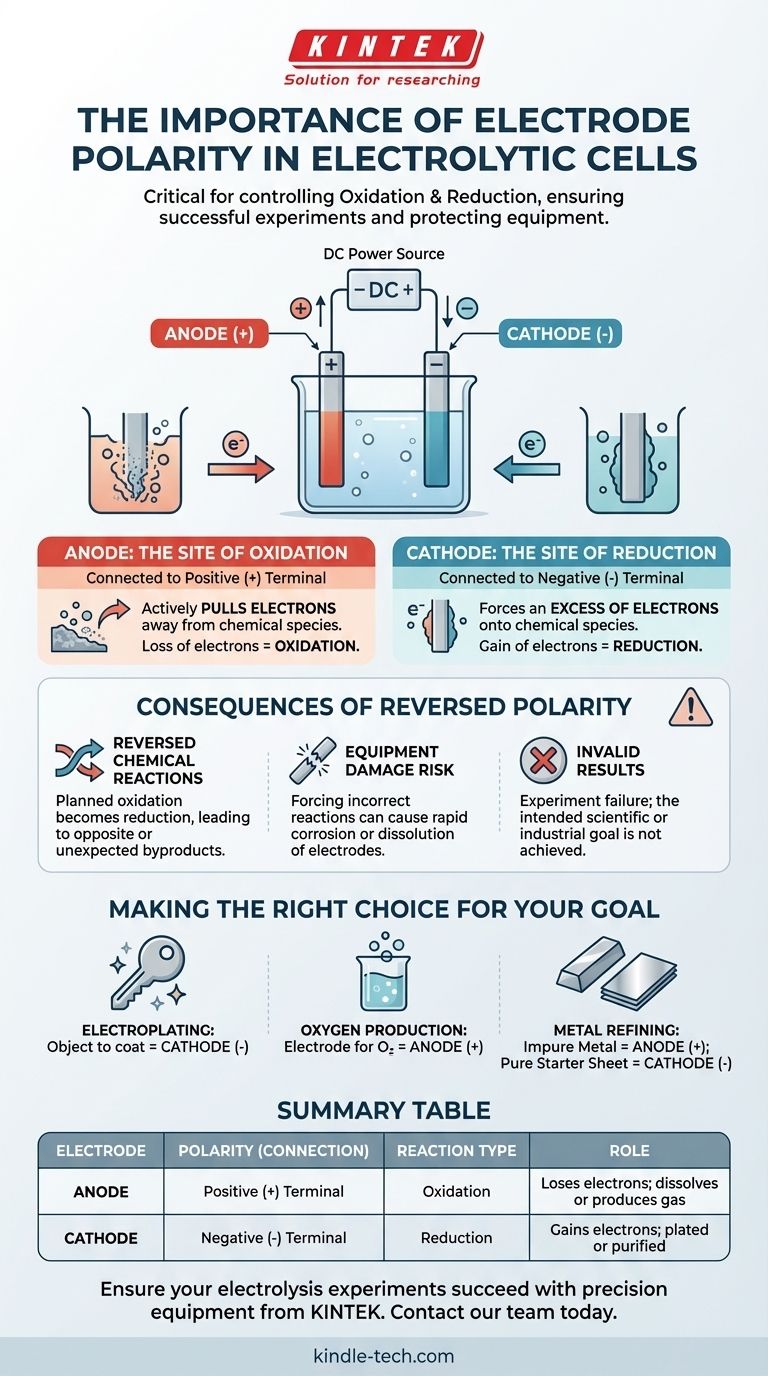
En una celda electrolítica, la polaridad correcta del electrodo es fundamental porque dicta dónde ocurren las reacciones químicas fundamentales de oxidación y reducción. El terminal positivo de la fuente de alimentación define el ánodo (el sitio de la oxidación) y el terminal negativo define el cátodo (el sitio de la reducción). Invertir estas conexiones revertirá la transformación química prevista, lo que provocará fallos en el experimento y posibles daños al equipo.
El principio central es este: la polaridad del electrodo no es una etiqueta arbitraria, sino el mecanismo de control directo de su reacción química. Determina qué electrodo pierde electrones (oxidación) y cuál los gana (reducción), controlando así qué sustancias se forman o consumen.

Los roles fundamentales del ánodo y el cátodo
Para comprender la importancia de la polaridad, primero debemos definir los roles de los dos electrodos en un proceso electrolítico. Estos roles son impulsados completamente por su conexión a una fuente de alimentación externa.
El ánodo: el sitio de la oxidación
El ánodo es el electrodo conectado al terminal positivo (+) de la fuente de alimentación.
Esta conexión positiva extrae activamente electrones de las especies químicas en la solución electrolítica que están cerca de la superficie del ánodo. Esta pérdida forzada de electrones se denomina oxidación.
El cátodo: el sitio de la reducción
El cátodo es el electrodo conectado al terminal negativo (-) de la fuente de alimentación.
Esta conexión negativa crea un exceso de electrones en la superficie del cátodo. Estos electrones son luego forzados hacia las especies químicas en la solución, haciendo que ganen electrones. Este proceso se denomina reducción.
La fuente de alimentación: la fuerza impulsora
A diferencia de una batería estándar (una celda galvánica) que produce energía a partir de una reacción espontánea, una celda electrolítica utiliza energía para impulsar una reacción no espontánea.
La fuente de alimentación externa actúa como una bomba de electrones. Los extrae del ánodo y los empuja hacia el cátodo, forzando un cambio químico que no ocurriría por sí solo.
Comprender las consecuencias de la polaridad invertida
Conectar los electrodos a los terminales incorrectos no es un error menor; altera fundamentalmente todo el experimento. Esto a menudo se denomina "invertir la polaridad".
Inviertes las reacciones químicas
Si inviertes las conexiones, el electrodo que pretendías que fuera el ánodo se convierte en el cátodo, y viceversa.
La reacción química que planeaste para el ánodo (oxidación) no ocurrirá. En cambio, ocurrirá una reacción de reducción allí. Esto significa que tu experimento producirá lo opuesto a tus resultados previstos, o creará subproductos completamente inesperados.
Te arriesgas a dañar tu equipo
Forzar una reacción en el material equivocado puede tener consecuencias destructivas. Por ejemplo, si estás realizando galvanoplastia, invertir la polaridad comenzará a disolver el objeto que pretendías recubrir.
En algunos casos, intentar oxidar un electrodo que no está diseñado para ello puede hacer que se corroa rápidamente. Esto puede contaminar tu solución y dañar permanentemente el electrodo.
Tus resultados no serán válidos
En última instancia, la polaridad invertida invalida el experimento. Si estás tratando de depositar una capa de cobre sobre una llave, invertir la configuración hará que la fuente de cobre se recubra con metal de la llave, disolviendo efectivamente la llave. El resultado es que no se logra el objetivo científico o industrial.
Tomar la decisión correcta para tu objetivo
Asignar correctamente la polaridad es cómo comandas el resultado químico. Antes de conectar tu fuente de alimentación, confirma qué electrodo debe ser el ánodo (+) y cuál debe ser el cátodo (-).
- Si tu enfoque principal es la galvanoplastia de un objeto: El objeto que deseas recubrir debe ser el cátodo (-), ya que es donde los iones metálicos positivos se reducirán a una capa de metal sólido.
- Si tu enfoque principal es producir gas oxígeno a partir de agua: El electrodo donde deseas que se forme el oxígeno debe ser el ánodo (+), ya que es donde se oxidan las moléculas de agua.
- Si tu enfoque principal es refinar metal impuro: El bloque de metal impuro debe ser el ánodo (+) para que pueda oxidarse y disolverse en la solución, mientras que una lámina inicial pura debe ser el cátodo (-) para recolectar el metal recién purificado.
Dominar la polaridad del electrodo te da control directo sobre las reacciones electroquímicas que deseas realizar.
Tabla de resumen:
| Electrodo | Polaridad (Conexión) | Tipo de reacción | Función |
|---|---|---|---|
| Ánodo | Terminal Positivo (+) | Oxidación | Pierde electrones; el objetivo se disuelve o produce gas (ej. O₂) |
| Cátodo | Terminal Negativo (-) | Reducción | Gana electrones; el objetivo se recubre o purifica |
Asegure el éxito de sus experimentos de electrólisis con equipos de precisión de KINTEK.
Ya sea que esté refinando metales, realizando galvanoplastia o llevando a cabo investigaciones, nuestros equipos y consumibles de laboratorio especializados están diseñados para la precisión y la durabilidad. Nuestros expertos pueden ayudarle a seleccionar las fuentes de alimentación y los electrodos adecuados para controlar perfectamente sus reacciones químicas.
No se arriesgue a obtener resultados inválidos o a dañar el equipo: comuníquese con nuestro equipo hoy mismo para analizar sus necesidades específicas de laboratorio.
Guía Visual
Productos relacionados
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celdas personalizables de electrólisis PEM para diversas aplicaciones de investigación
- Celda de Flujo Personalizable para Reducción de CO2 para Investigación de NRR, ORR y CO2RR
La gente también pregunta
- ¿Cuáles son las aplicaciones principales de la celda electrolítica totalmente de cuarzo? Esencial para análisis ópticos y de alta pureza
- ¿Cómo se debe mantener una celda electrolítica de cuarzo y sus componentes para un uso prolongado? Una guía para maximizar la vida útil del equipo
- ¿Cuáles son las especificaciones estándar de apertura para las celdas electrolíticas de cuarzo totalmente selladas y no selladas? Optimice su configuración electroquímica
- ¿Cuáles son los pasos necesarios para preparar una celda electrolítica totalmente de cuarzo antes de un experimento? Garantice la precisión y la seguridad
- ¿Qué precauciones se deben tomar al manipular y usar una celda electrolítica de cuarzo puro? Garantice un rendimiento seguro, preciso y duradero



















