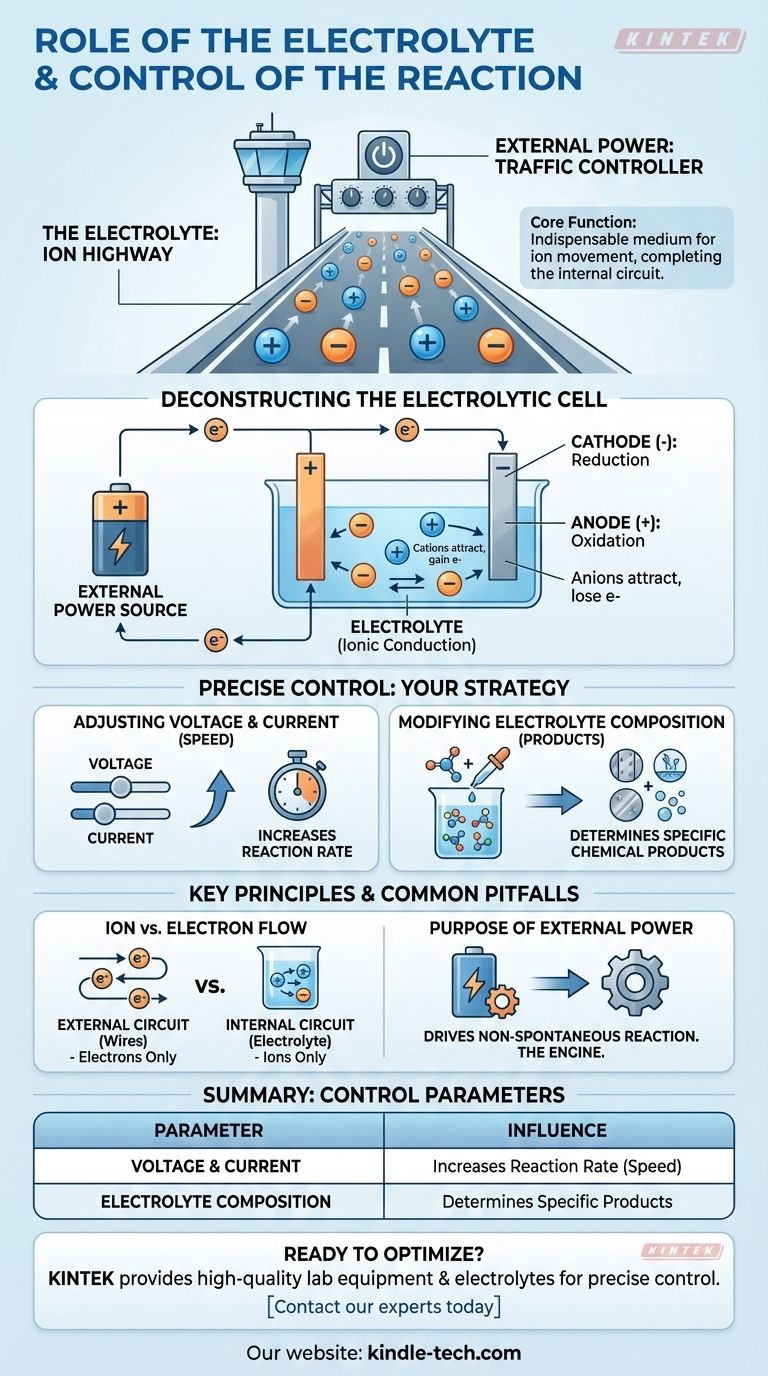
En esencia, el electrolito es el medio indispensable para el movimiento de iones dentro de una celda, completando el circuito eléctrico que permite que ocurra una reacción química. La reacción en sí se controla con precisión manipulando las entradas eléctricas externas —específicamente el voltaje y la corriente— y cambiando la composición química de la solución electrolítica.
El electrolito actúa como una "autopista de iones", permitiendo que las partículas cargadas viajen entre los electrodos dentro de la celda. La fuente de alimentación externa actúa como el "controlador de tráfico", dictando la velocidad y dirección de la reacción química al gestionar el flujo de electrones.

El papel fundamental del electrolito
Una reacción electroquímica requiere un circuito completo. El electrolito es responsable de la mitad interna de ese circuito, un papel fundamentalmente diferente al de los cables conectados externamente.
¿Qué es un electrolito?
Un electrolito es una solución, típicamente acuosa u orgánica, que contiene iones disociados.
Estos iones positivos y negativos de libre flotación son lo que hacen que la solución sea eléctricamente conductora.
Permitir la conducción iónica
La función principal del electrolito es la conducción iónica.
Mientras que los electrones fluyen a través de los cables externos, los iones deben fluir a través de la solución entre los dos electrodos. Este movimiento de iones cargados completa el circuito, permitiendo que la reacción se mantenga.
Deconstruyendo la celda electrolítica
En una celda electrolítica, una fuente de energía externa impulsa una reacción química que de otro modo no ocurriría por sí sola. Así es como los componentes trabajan juntos.
La fuente de alimentación externa
El proceso comienza con una fuente de alimentación externa, como una batería o una fuente de energía.
Esta fuente bombea activamente electrones, creando una diferencia de carga entre los dos electrodos que fuerza la reacción a proceder.
El cátodo (el sitio de reducción)
La fuente externa empuja los electrones hacia el cátodo, dándole una carga negativa.
Esta carga negativa atrae a los iones cargados positivamente (cationes) del electrolito. Cuando estos iones llegan al cátodo, ganan electrones en un proceso llamado reducción.
El ánodo (el sitio de oxidación)
Simultáneamente, la fuente externa extrae electrones del ánodo, dándole una carga positiva.
Esta carga positiva atrae a los iones cargados negativamente (aniones) del electrolito. En el ánodo, estos iones pierden electrones en un proceso conocido como oxidación.
Cómo se controla con precisión la reacción
Usted tiene control directo sobre el resultado y la velocidad de la reacción electroquímica ajustando tres parámetros clave.
Ajuste de voltaje y corriente
El voltaje puede considerarse como la "presión" eléctrica que impulsa la reacción, mientras que la corriente es la velocidad del flujo de electrones.
Aumentar el voltaje y la corriente generalmente aumentará la velocidad a la que ocurre la reacción química. Esto le da un control directo y en tiempo real sobre la velocidad del proceso.
Modificación de la composición del electrolito
La reacción química específica que tiene lugar está determinada por los iones disponibles en el electrolito.
Al cambiar la composición del electrolito —por ejemplo, usando una sal o un disolvente diferente— puede cambiar los productos que se forman en el ánodo y el cátodo.
Errores comunes y principios clave
Para comprender verdaderamente el sistema, es fundamental distinguir entre las dos mitades del circuito y la naturaleza de la celda.
Movimiento de iones vs. flujo de electrones
Un punto común de confusión es la diferencia entre lo que sucede dentro y fuera de la celda.
Los electrones fluyen solo a través del circuito externo (los cables). Los iones fluyen solo a través del circuito interno (el electrolito). La reacción en las superficies de los electrodos es lo que conecta estas dos vías distintas.
El propósito de la energía externa
Es crucial recordar que este proceso describe una celda electrolítica.
En estas celdas, la energía eléctrica se utiliza para impulsar una reacción química no espontánea. La fuente de energía externa no es opcional; es el motor que hace posible todo el proceso.
Tomar la decisión correcta para su objetivo
Su estrategia de control depende enteramente de lo que quiera lograr con la reacción.
- Si su objetivo principal es acelerar la velocidad de reacción: Aumente el voltaje y la corriente aplicados para impulsar el flujo de electrones e iones más rápidamente.
- Si su objetivo principal es crear un producto químico específico: Seleccione y controle cuidadosamente la composición del electrolito para asegurarse de que los iones deseados estén disponibles para la reacción.
- Si su objetivo principal es comprender la eficiencia del sistema: Debe monitorear tanto el flujo de electrones (corriente) en el circuito externo como el cambio químico resultante (conversión de iones) en los electrodos.
En última instancia, dominar un proceso electroquímico significa comprender que el electrolito y el circuito externo son dos mitades de un sistema único y controlable.
Tabla resumen:
| Parámetro de control | Cómo influye en la reacción |
|---|---|
| Voltaje y Corriente | Aumenta la velocidad (tasa) de la reacción química. |
| Composición del Electrolito | Determina los productos químicos específicos formados. |
¿Listo para optimizar su proceso electroquímico?
Ya sea que esté desarrollando nuevos materiales, realizando galvanoplastia o llevando a cabo pruebas analíticas precisas, controlar su reacción electroquímica es fundamental. KINTEK se especializa en proporcionar equipos de laboratorio y consumibles de alta calidad para todas sus necesidades de laboratorio, incluyendo fuentes de alimentación confiables y electrolitos puros.
Contacte a nuestros expertos hoy para discutir cómo podemos ayudarle a lograr un control preciso y resultados superiores en su laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
La gente también pregunta
- ¿Cuáles son las especificaciones de apertura estándar para una celda electrolítica de membrana intercambiable tipo H? Puertos asimétricos para electroquímica precisa
- ¿Cuáles son los volúmenes típicos y las configuraciones de apertura para una celda electrolítica de baño de agua de doble capa? Optimice su configuración electroquímica
- ¿Cuáles son las características clave de una celda electrolítica de doble capa con baño de agua? Logre un control preciso de la temperatura para sus experimentos
- ¿Qué características ópticas tiene la celda electrolítica tipo H? Ventanas de cuarzo de precisión para fotoelectroquímica
- ¿Cuál es el sistema experimental típico utilizado con una celda electrolítica de doble capa con baño de agua? Logre un control electroquímico preciso



















