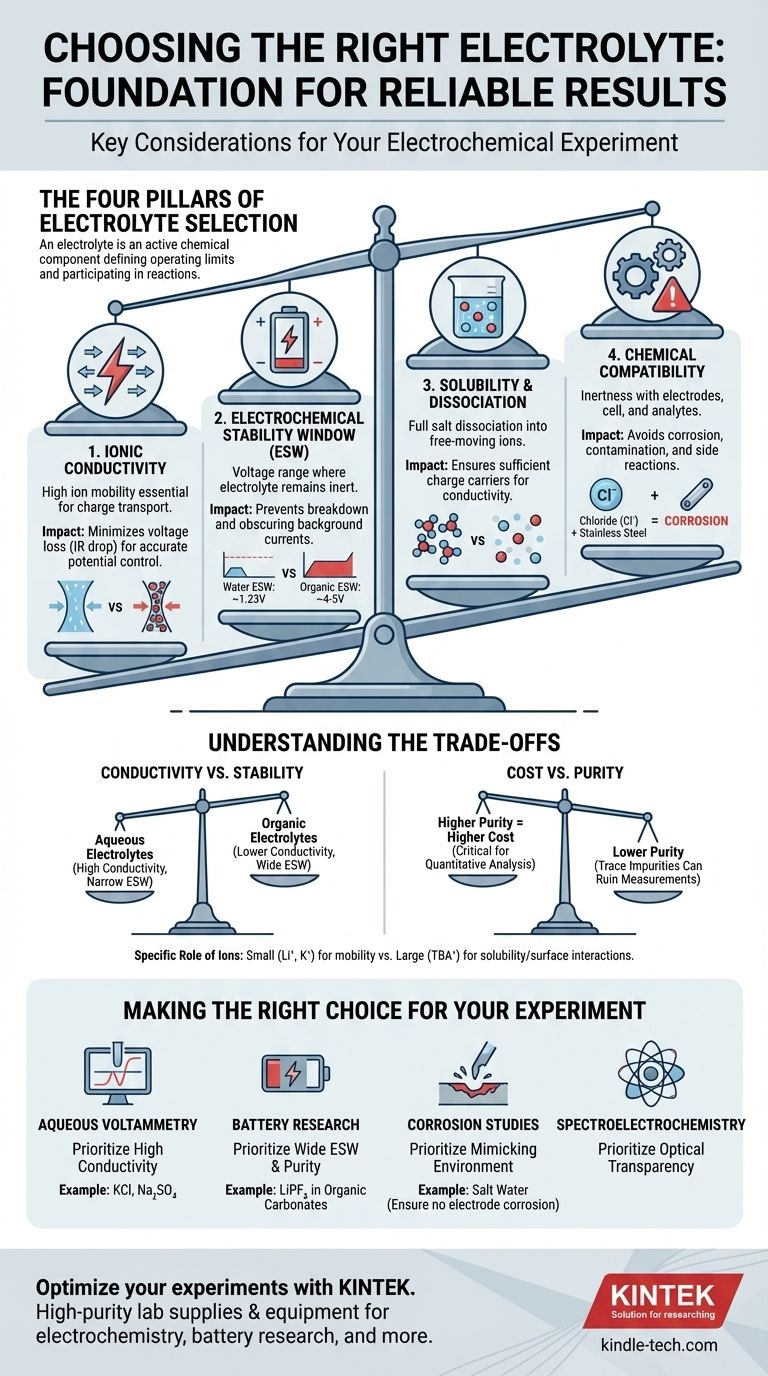
Al seleccionar un electrolito para un experimento, debe evaluar cuatro propiedades clave: su conductividad iónica, su ventana de estabilidad electroquímica, su solubilidad en el solvente elegido y su compatibilidad química con todo su sistema experimental. Estos factores determinan colectivamente si el electrolito apoyará la reacción que desea estudiar o introducirá artefactos que invalidarán sus resultados.
La conclusión principal es que un electrolito no es meramente un conductor pasivo. Es un componente químico activo que define los límites operativos de su celda electroquímica y puede participar directamente en reacciones secundarias, lo que hace que su cuidadosa selección sea fundamental para obtener datos fiables y significativos.

Los Cuatro Pilares de la Selección de Electrolitos
Elegir el electrolito adecuado es un proceso de equilibrio de requisitos. El electrolito ideal facilita la reacción deseada mientras permanece completamente inerte e invisible para la medición. Podemos desglosar este proceso de selección en cuatro consideraciones críticas.
Pilar 1: Conductividad Iónica
La función principal de un electrolito es transportar carga entre los electrodos. Una alta conductividad iónica es esencial para esto.
Una conductividad deficiente conduce a una gran caída óhmica (o caída IR), que es una pérdida de voltaje a través del electrolito. Esto significa que el potencial que aplica a su celda no es el potencial que realmente se experimenta en la superficie del electrodo, lo que lleva a mediciones inexactas de los potenciales de reacción.
Piense en el electrolito como una autopista para los iones. Un electrolito de alta conductividad es una superautopista ancha y despejada, mientras que uno de baja conductividad es una calle lateral congestionada, que ralentiza todo y desperdicia energía.
Pilar 2: Ventana de Estabilidad Electroquímica (ESW)
La ventana de estabilidad electroquímica (ESW) es el rango de potenciales donde el electrolito en sí mismo —tanto la sal como el solvente— no se oxida ni se reduce.
Operar fuera de esta ventana es un fallo crítico. Si aplica un potencial demasiado positivo o demasiado negativo, comenzará a descomponer el electrolito en lugar de estudiar su analito. Esto crea grandes corrientes de fondo que pueden oscurecer completamente la señal que está tratando de medir.
Por ejemplo, la ESW del agua es de solo aproximadamente 1.23 V. Para experimentos que requieren potenciales más altos, como en la investigación de baterías de iones de litio, debe cambiar a solventes orgánicos y sales específicas (p. ej., LiPF₆ en carbonatos orgánicos) que ofrecen una ventana mucho más amplia (~4-5 V).
Pilar 3: Solubilidad y Disociación
Para que un electrolito funcione, la sal no solo debe disolverse, sino también disociarse completamente en cationes y aniones de libre movimiento en el solvente.
Si la sal tiene poca solubilidad o forma "pares iónicos" apretados en lugar de separarse, el número de portadores de carga disponibles disminuye drásticamente. Esto reduce directamente la conductividad iónica, socavando la función principal del electrolito.
Asegúrese siempre de que la sal elegida sea altamente soluble en el solvente elegido a la concentración que pretende usar (típicamente de 0.1 M a 1.0 M para experimentos a escala de laboratorio).
Pilar 4: Compatibilidad Química
El electrolito debe ser químicamente inerte con respecto a cada componente de su celda: el electrodo de trabajo, el contraelectrodo, el electrodo de referencia y el propio cuerpo de la celda.
Un error común es usar un electrolito que contenga iones cloruro (como KCl) con componentes de acero inoxidable. El cloruro es altamente corrosivo para el acero inoxidable y causará picaduras y liberará iones metálicos en su solución, contaminando el experimento.
De manera similar, los iones del electrolito no deben reaccionar con la superficie del electrodo ni adsorberse demasiado fuertemente en ella, a menos que esa interacción sea el fenómeno específico que está estudiando.
Comprendiendo las Compensaciones
No existe un único electrolito "mejor"; cada elección implica equilibrar factores contrapuestos. Comprender estas compensaciones es la marca de un investigador experimentado.
Conductividad vs. Estabilidad
Los electrolitos acuosos (p. ej., NaCl en agua) ofrecen una excelente conductividad iónica, pero tienen una ventana de estabilidad electroquímica muy estrecha. Por el contrario, muchos electrolitos basados en solventes orgánicos proporcionan una amplia ventana de estabilidad, pero a menudo sufren de menor conductividad. Su elección depende de si su experimento está limitado por el voltaje o la eficiencia de la corriente.
Costo vs. Pureza
Las sales y solventes de alta pureza, de "grado batería" o "grado electroquímico", son significativamente más caros. Sin embargo, las impurezas traza (como el agua en un electrolito no acuoso o los iones haluro) pueden introducir señales electroquímicas no deseadas y arruinar mediciones sensibles. Para demostraciones simples, un grado inferior puede ser suficiente, pero para el análisis cuantitativo, invertir en pureza es crítico.
El Papel Específico de los Iones
No todos los iones son iguales. Los iones pequeños y móviles como el litio (Li⁺) o el potasio (K⁺) son excelentes portadores de carga. Sin embargo, los iones orgánicos grandes como el tetrabutilamonio (TBA⁺) a menudo se usan para aumentar la solubilidad de los analitos no polares en solventes polares y pueden ayudar a minimizar las interacciones no deseadas en la superficie del electrodo.
Tomando la Decisión Correcta para su Experimento
Su objetivo específico dicta qué propiedades priorizar.
- Si su enfoque principal es la voltamperometría acuosa estándar: Priorice la alta conductividad y use una sal simple e inerte como el cloruro de potasio (KCl) o el sulfato de sodio (Na₂SO₄), asegurándose de que su rango de potencial se mantenga dentro de la ventana de estabilidad del agua.
- Si su enfoque principal es la investigación de baterías de alto voltaje: Priorice una amplia ventana de estabilidad electroquímica y una pureza extrema, utilizando típicamente sales como LiPF₆ o LiClO₄ en una mezcla de solventes de carbonato orgánico.
- Si su enfoque principal son los estudios de corrosión: Priorice la creación de un electrolito que imite con precisión el entorno del mundo real (p. ej., agua salada), asegurándose de que no corroa sus electrodos de referencia o contraelectrodos.
- Si su enfoque principal es la espectroelectroquímica: Priorice la transparencia óptica tanto de la sal como del solvente en su rango de longitud de onda deseado, además de los requisitos electroquímicos estándar.
En última instancia, el electrolito que elija sienta las bases y define las reglas para toda su medición electroquímica.
Tabla Resumen:
| Pilar de Selección | Consideración Clave | Impacto en el Experimento |
|---|---|---|
| Conductividad Iónica | Alta movilidad iónica | Minimiza la pérdida de voltaje (caída IR) para un control preciso del potencial. |
| Ventana de Estabilidad Electroquímica (ESW) | Rango de voltaje de estabilidad | Evita la descomposición del electrolito y las corrientes de fondo que oscurecen la señal. |
| Solubilidad y Disociación | Disociación completa de la sal en iones | Asegura suficientes portadores de carga para una conductividad efectiva. |
| Compatibilidad Química | Inercia con los componentes de la celda | Evita la corrosión, la contaminación y las reacciones secundarias no deseadas. |
¿Listo para optimizar sus experimentos electroquímicos con el equipo y los consumibles de laboratorio adecuados? El electrolito correcto es solo una parte de la ecuación. KINTEK se especializa en proporcionar suministros y equipos de laboratorio de alta pureza adaptados para electroquímica, investigación de baterías, estudios de corrosión y más. Nuestros productos le ayudan a lograr el control preciso y los datos fiables que su trabajo exige.
Contacte a nuestros expertos hoy para discutir sus necesidades específicas de aplicación y descubra cómo KINTEK puede apoyar el éxito de su laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Electroquímica de Baño de Agua de Doble Capa
- Célula electroquímica de electrólisis espectral de capa fina
La gente también pregunta
- ¿Cuál es el sistema experimental típico utilizado con una celda electrolítica de doble capa con baño de agua? Logre un control electroquímico preciso
- ¿Cuál es la estructura de una celda electrolítica de membrana intercambiable tipo H? Una guía para la separación electroquímica precisa
- ¿Cómo se debe almacenar la celda electrolítica tipo H cuando no está en uso? Guía experta de almacenamiento y mantenimiento
- ¿Cuáles son las especificaciones de apertura estándar para una celda electrolítica de membrana intercambiable tipo H? Puertos asimétricos para electroquímica precisa
- ¿Qué características ópticas tiene la celda electrolítica tipo H? Ventanas de cuarzo de precisión para fotoelectroquímica



















