Introducción a los electrodos de referencia
Definición y función
Un electrodo de referencia es un componente crucial en los estudios electroquímicos, ya que sirve como punto de referencia para medir la diferencia de potencial con respecto a un electrodo de estudio. Esta medición es esencial para evaluar con precisión el comportamiento del electrodo de estudio en diversas condiciones. Normalmente, el potencial de un electrodo de referencia se mide en relación con un electrodo de hidrógeno estándar reversible (RHE) que se considera el estándar universal debido a su potencial bien definido y estable.

El papel del electrodo de referencia va más allá de la mera medición; garantiza la coherencia y fiabilidad de los datos electroquímicos. Al proporcionar un potencial estable y conocido, permite realizar comparaciones precisas entre diferentes experimentos y condiciones. Esta estabilidad es crucial en campos como los estudios de corrosión, la investigación de baterías y la monitorización medioambiental, donde incluso pequeñas variaciones en el potencial pueden afectar significativamente a los resultados.
En aplicaciones prácticas, el electrodo de referencia debe cumplir unos criterios específicos para garantizar su eficacia. Debe presentar un potencial conocido y estable a lo largo del tiempo y en condiciones variables, garantizando que las mediciones sean coherentes. Además, el electrodo debe ser reversible lo que significa que puede sufrir procesos de oxidación y reducción sin cambiar sus propiedades fundamentales. El electrolito del electrodo de referencia también debe ser químicamente inerte, para evitar reacciones no deseadas con el electrolito de la célula electrolítica u otras sustancias relacionadas.
Por ejemplo, en una configuración típica, el electrodo de referencia podría estar emparejado con un electrodo de electrodo Ag/AgCl o un electrodo de Hg/Hg2SO4 cada uno con su solución electrolítica específica. Estas combinaciones garantizan que el electrodo de referencia mantenga su estabilidad y precisión, proporcionando datos fiables para las medidas de potencial del electrodo de estudio.
Condiciones para un buen electrodo de referencia
Un electrodo de referencia debe presentar varias características críticas para funcionar eficazmente en estudios electroquímicos. En primer lugar, debe mantener un potencial conocido y estable durante todo su uso. Esta estabilidad garantiza que las mediciones de potencial realizadas sean fiables y coherentes, lo que resulta crucial para la obtención de datos precisos.
En segundo lugar, el electrodo debe ser reversible lo que significa que puede sufrir reacciones de oxidación y reducción sin cambios significativos en su potencial. Esta reversibilidad es esencial para mantener la integridad del electrodo y garantizar que pueda utilizarse repetidamente sin degradación.
Además, el electrolito del electrodo de referencia debe elegirse cuidadosamente. No debe reaccionar químicamente con el electrolito de la célula electrolítica ni con ninguna sustancia relacionada. Tales reacciones podrían alterar el potencial del electrodo, dando lugar a mediciones erróneas. Por ejemplo, si el electrolito del electrodo de referencia reacciona con la solución de muestra, podría provocar un desplazamiento del potencial de referencia, comprometiendo la precisión de las lecturas.
Además, el electrodo de referencia debe ser compatible con la muestra que se mide . Esta compatibilidad garantiza que no se produzcan interacciones químicas no deseadas entre la muestra y el electrolito, que podrían afectar a la estabilidad del potencial del electrodo. Por ejemplo, ciertas sustancias químicas de la muestra podrían degradar el material del electrodo, lo que requiere la selección de materiales apropiados como el vidrio, el epoxi u otras sustancias adecuadas.
En aplicaciones prácticas, a menudo es más eficaz utilizar una electrodo sensor (semicelda) y de referencia separados si se espera que las distintas partes del electrodo tengan una vida útil diferente. Esta separación permite sustituir más fácilmente los componentes desgastados sin desechar todo el electrodo. Además, en algunas aplicaciones especializadas, el uso de un electrodo de referencia separado no sólo es práctico, sino también necesario para lograr la precisión y eficacia deseadas.
Por ejemplo, en la voltamperometría cíclica (CV), utilizar un simple alambre de Ag sumergido directamente en la solución analítica como electrodo de referencia es teóricamente posible, pero no recomendable. La lenta pérdida de iones Ag+ podría interactuar con el analito, y cualquier cambio en la solución electrolítica podría alterar el potencial de referencia. En su lugar, la mejor práctica consiste en aislar el electrodo de referencia de la solución analítica utilizando una frita de vycor (vidrio poroso). Esta configuración mantiene el contacto eléctrico a la vez que minimiza la mezcla de la solución, preservando así la estabilidad del potencial de referencia.
También hay que tener cuidado para evitar que la frita vycor se seque, ya que esto puede hacer que la sal electrolítica se cristalice en los poros, inutilizando el electrodo. Las comprobaciones periódicas, como intentar exprimir líquido a través de la frita utilizando una pera de pipeta, pueden ayudar a garantizar su integridad. Los electrodos de referencia de Ag/AgCl acuosos disponibles en el mercado deben almacenarse en la oscuridad y sumergirse en soluciones idénticas a la solución del interior del electrodo de referencia, normalmente KCl saturado. Con el tiempo, los electrodos de Ag/AgCl pueden desarrollar una acumulación blanca en el alambre y desviarse de su potencial de referencia anunciado, lo que requiere una supervisión cuidadosa y su sustitución cuando sea necesario.
En resumen, un buen electrodo de referencia debe combinar estabilidad, reversibilidad y compatibilidad química para proporcionar mediciones de potencial fiables y precisas en experimentos electroquímicos.
Calibración y corrección de electrodos de referencia

Proceso de calibración
La calibración de un electrodo de referencia es un proceso meticuloso que garantiza la precisión y fiabilidad de las medidas de potencial en estudios electroquímicos. El procedimiento suele implicar la configuración de un sistema de tres electrodos, en el que el electrodo de referencia sometido a calibración sirve como electrodo de trabajo. El sistema se completa incorporando un electrodo de Ag/AgCl como electrodo de referencia y un electrodo de platino (Pt) como contraelectrodo.
Para conseguir una calibración precisa, se emplea el método de prueba de monitorización del potencial de circuito abierto. Este método consiste en monitorizar el potencial del electrodo de trabajo a lo largo del tiempo hasta obtener una lectura estable. La estabilidad de la curva de potencial es crucial, ya que indica que el electrodo de referencia funciona correctamente y de forma constante.
| Componente | Función en la calibración |
|---|---|
| Electrodo de trabajo | Electrodo de referencia sometido a prueba |
| Electrodo de referencia | Electrodo Ag/AgCl |
| Contraelectrodo | Electrodo de Pt |
El método de ensayo de control del potencial en circuito abierto es especialmente ventajoso porque permite identificar cualquier deriva o inestabilidad en el potencial del electrodo de referencia. Este método no es invasivo y no requiere ninguna corriente externa, por lo que es una opción ideal para mantener la integridad del entorno del electrodo de referencia durante la calibración.
En resumen, el proceso de calibración de un electrodo de referencia es un paso fundamental para garantizar la precisión de las mediciones electroquímicas. Utilizando un sistema de tres electrodos y empleando el método de prueba de monitorización del potencial de circuito abierto, los investigadores pueden obtener una curva de potencial estable y fiable, validando así el rendimiento del electrodo de referencia.
Fórmula de corrección
El potencial real del electrodo de referencia puede determinarse con precisión utilizando una fórmula de corrección específica. Esta fórmula, expresada como ( E_X = x - 0,197 ), es esencial para garantizar la precisión y fiabilidad de las mediciones electroquímicas. En esta ecuación, ( x ) representa el potencial medido del electrodo de referencia, mientras que la constante 0,197 corresponde al potencial de electrodo conocido del electrodo Ag/AgCl.
Para entender el significado de esta corrección, es importante reconocer que el electrodo de Ag/AgCl sirve como referencia estándar en muchos experimentos electroquímicos. Su potencial estable y bien documentado permite una calibración coherente en diferentes configuraciones. Al restar el potencial del electrodo de Ag/AgCl del valor medido, los investigadores pueden obtener el verdadero potencial de su electrodo de referencia, eliminando así posibles discrepancias y mejorando la precisión de sus datos.
Este proceso de corrección es particularmente crucial en experimentos en los que incluso pequeñas variaciones en el potencial del electrodo pueden afectar significativamente a los resultados. Por lo tanto, la fórmula ( E_X = x - 0,197 ) no es sólo un ajuste matemático, sino un paso crítico para mantener la integridad de las mediciones electroquímicas.
Electrodos de referencia comúnmente utilizados
Electrodo de Hg/Hg₂SO₄
El electrodo Hg/Hg₂SO₄ se construye con una amalgama sólida de mercurio y sulfato de mercurio(I), encapsulada dentro de una solución de iones sulfato. Concretamente, la configuración del electrodo se representa como Hg/Hg₂SO₄(sólido)/SO₄²- y normalmente se sumerge en una solución de sulfato 0,1M. Esta configuración garantiza un potencial estable y bien definido, lo que lo convierte en una referencia fiable en diversas aplicaciones electroquímicas.
A diferencia de otros electrodos de referencia, como el electrodo de cloruro de plata-plata, que se basa en la precipitación de AgCl en el electrolito, el electrodo Hg/Hg₂SO₄ aprovecha la interacción en estado sólido entre el mercurio y su compuesto de sulfato. Esta estructura única no sólo proporciona una base sólida para la medición del potencial, sino que también minimiza el riesgo de contaminación o inestabilidad, que puede ser común en electrodos que implican interfaces líquido-líquido.
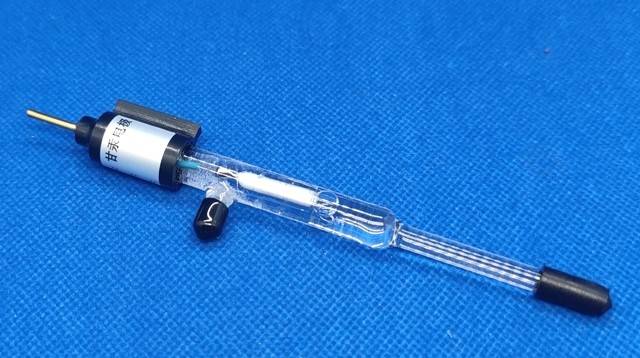
El uso de una solución de sulfato 0,1 M mejora aún más el rendimiento del electrodo al mantener un entorno iónico constante alrededor de la amalgama de mercurio. Esta concentración se elige cuidadosamente para equilibrar la necesidad de una movilidad iónica suficiente con el requisito de una interferencia mínima del electrolito. Como resultado, el electrodo Hg/Hg₂SO₄ sigue siendo una elección popular para aplicaciones en las que la alta precisión y la estabilidad a largo plazo son primordiales.
Electrodo de ácido mercúrico saturado
El electrodo de ácido mercúrico saturado (SMAE) es un componente crítico en los estudios electroquímicos, especialmente conocido por su estructura compuesta por mercurio (Hg), cloruro mercurioso (Hg₂Cl₂, también conocido como calomelano) y una solución saturada de cloruro potásico (KCl). Este electrodo está diseñado para mantener un potencial estable y reproducible, lo que resulta esencial para realizar mediciones precisas en diversos experimentos electroquímicos.
La estructura del SMAE es sencilla pero muy eficaz. Consiste en una piscina de mercurio en el fondo, sobre la que se deposita una capa de calomelano sólido. Esta capa de calomelano actúa como intermediario entre el mercurio y la solución electrolítica. La solución saturada de KCl incorporada garantiza que el electrodo permanezca en un estado de equilibrio, proporcionando un potencial de referencia constante.
Una de las principales ventajas del SMAE es su capacidad para funcionar en un entorno de KCl saturado, lo que ayuda a mantener una alta concentración de iones cloruro. Esta saturación es crucial, ya que minimiza las fluctuaciones de potencial y garantiza un potencial de referencia estable durante periodos prolongados, lo que lo hace especialmente adecuado para experimentos a largo plazo.
En resumen, el diseño del SMAE, con su estructura Hg/Hg₂Cl₂(sólido)/KCl y el uso de una solución saturada de KCl, ofrece un potencial de referencia robusto y fiable, lo que lo convierte en la opción preferida en muchas aplicaciones electroquímicas.
Electrodo de plata/cloruro de plata
El electrodo de plata/cloruro de plata (Ag/AgCl) es un electrodo de referencia muy utilizado debido a su rentabilidad y reducida toxicidad en comparación con otros electrodos de referencia como el electrodo de Calomel. Este electrodo se compone de un hilo de plata (Ag) recubierto de una capa de cloruro de plata (AgCl) sólido, que se sumerge en una solución saturada tanto de cloruro de potasio (KCl) como de cloruro de plata (AgCl). La estructura del electrodo puede representarse como Ag/AgCl(sólido)/KCl.
El electrodo funciona basándose en la siguiente semirreacción:
$$ \text{AgCl(s)} + \text{e}^- \leftrightarrow \text{Ag(s)} + \text{Cl}^-(\text{sat'd}) $$
A 25°C, esta reacción produce un potencial de 0,197 V con respecto al electrodo de hidrógeno estándar (SHE). Este valor se desvía ligeramente del potencial del electrodo estándar (E0) de 0,222 V debido a la contribución tanto del KCl como del AgCl a la actividad del cloruro, que no es exactamente la unidad.
El electrodo de Ag/AgCl es preferible por varias razones:
- Estabilidad: Mantiene un potencial de media celda estable a lo largo del tiempo.
- Dependencia de la temperatura: El potencial cambia aproximadamente 0,5 - 1,0 mV/°C, lo que es relativamente mínimo.
- Solución saturada: La pérdida de electrolito por evaporación no altera la naturaleza saturada de la solución, preservando así el potencial del electrodo.
A menudo se ilustra una representación esquemática del electrodo de referencia Ag/AgCl para proporcionar una comprensión visual clara de su construcción y funcionamiento.
Electrodo de mercurio/óxido de mercurio
El electrodo de mercurio/óxido de mercurio (electrodo MMO) es un componente crítico en los estudios electroquímicos, caracterizado por su estructura única. Este electrodo está compuesto por una capa metálica de mercurio (Hg) en contacto directo con una capa sólida de óxido de mercurio (HgO), todo ello inmerso en una solución concentrada de hidróxido de potasio (KOH). Concretamente, la solución incorporada suele ser una solución de KOH 1M, que desempeña un papel vital en el mantenimiento de la estabilidad y el rendimiento del electrodo.
El electrodo MMO es especialmente apreciado por su capacidad para proporcionar un potencial estable y reproducible, lo que lo convierte en una opción ideal para diversas aplicaciones electroquímicas. La solución de KOH no sólo garantiza la funcionalidad del electrodo, sino que también ayuda a prevenir la contaminación y a mantener la longevidad del electrodo. Esta configuración permite que el electrodo MMO sirva eficazmente como electrodo de referencia, ofreciendo lecturas de potencial consistentes que son cruciales para mediciones electroquímicas precisas.
En resumen, el electrodo de mercurio/óxido de mercurio destaca por su estructura robusta y el uso de una solución de KOH 1M, que contribuyen colectivamente a su fiabilidad y eficacia en la investigación electroquímica.
Selección y mantenimiento de electrodos de referencia
Criterios de selección
A la hora de seleccionar un electrodo de referencia, es fundamental asegurarse de que la solución incorporada coincida con el sistema de investigación para evitar cualquier posible contaminación. Esta adecuación es esencial porque el electrolito del electrodo de referencia no debe reaccionar con el electrolito de la célula electrolítica o sustancias relacionadas, lo que podría comprometer la precisión de sus mediciones.
Por ejemplo, cuando se trabaja con soluciones de H₂SO₄ el electrodo Hg/Hg₂SO₄ es la elección ideal. Este electrodo, con su estructura de Hg/Hg₂SO₄(sólido)/SO₄²-, viene equipado con una solución incorporada de solución de sulfato 0,1M, lo que lo hace perfectamente adecuado para entornos de ácido sulfúrico. Por otro lado, para soluciones de cloruro el electrodo Ag/AgCl es la opción preferida. Este electrodo, estructurado como Ag/AgCl(sólido)/KCl, incluye una solución integrada de solución de KCl 0,1M, que es óptima para los sistemas de investigación basados en cloruros.
| Tipo de solución | Electrodo recomendado | Estructura del electrodo | Solución incorporada |
|---|---|---|---|
| H₂SO₄ Soluciones | Hg/Hg₂SO₄ Electrodo | Hg/Hg₂SO₄(sólido)/SO₄²- | Solución de sulfato 0,1M |
| Soluciones de cloruro | Electrodo Ag/AgCl | Ag/AgCl(sólido)/KCl | Solución de KCl 0,1M |
Al adaptar cuidadosamente el electrodo de referencia al tipo de solución, puede reducir significativamente el riesgo de contaminación y garantizar mediciones electroquímicas más fiables y precisas.
Consejos de mantenimiento
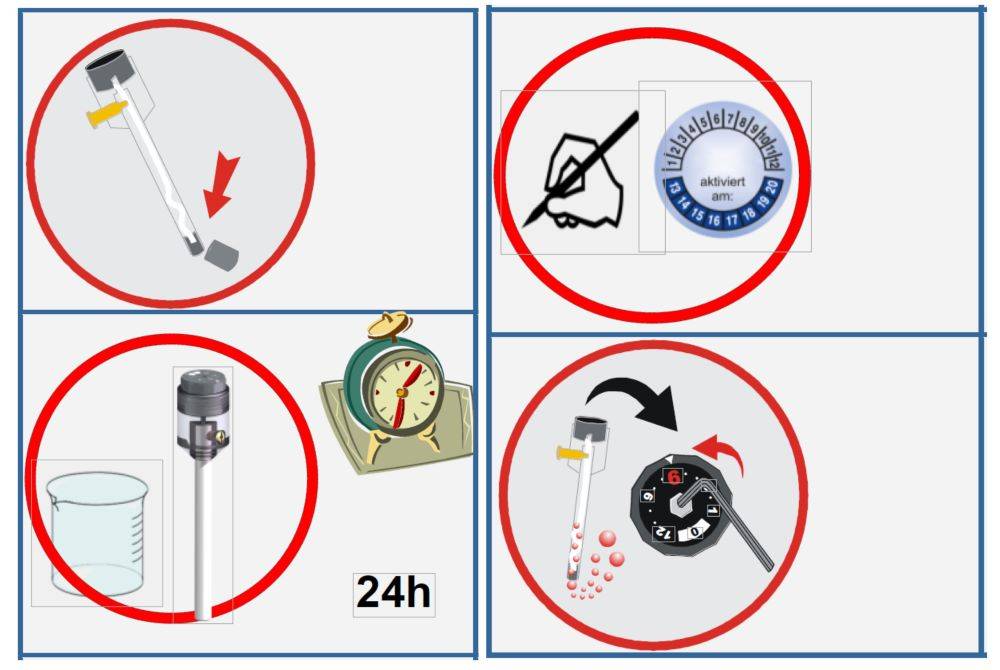
El mantenimiento adecuado de los electrodos de referencia es crucial para mantener su precisión y longevidad. Para garantizar un rendimiento óptimo, siga estos consejos esenciales de mantenimiento:
-
Condiciones de almacenamiento: Almacene el electrodo de referencia a temperatura ambiente para evitar posibles fluctuaciones causadas por temperaturas extremas. Además, proteja el electrodo de la luz directa para evitar cualquier degradación de los materiales.
-
Gestión de la solución de llenado: Sustituya regularmente la solución de relleno para mantener la estabilidad del potencial del electrodo. La frecuencia de sustitución depende de la tasa de uso, pero en general es aconsejable comprobar y sustituir la solución cada pocas semanas para garantizar la consistencia.
-
Prevención de burbujas de aire: Asegúrese de que no haya burbujas de aire en la solución incorporada. Las burbujas de aire pueden interferir en el rendimiento del electrodo al crear una barrera que interrumpe la conexión eléctrica. Inspeccione regularmente la solución y golpee suavemente el electrodo para eliminar el aire atrapado.
Siguiendo estas prácticas de mantenimiento, puede mejorar significativamente la fiabilidad y la vida útil de sus electrodos de referencia, asegurando resultados precisos y consistentes en sus estudios electroquímicos.
Productos relacionados
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo de Referencia de Sulfato de Cobre para Uso en Laboratorio
- Electrodo de Disco de Oro
- Celda electrolítica para corrosión plana
- Material de pulido de electrodos para experimentos electroquímicos
Artículos relacionados
- Electrolitos y electrodos electroquímicos
- Comprensión de los electrodos de referencia de calomelanos saturados: Composición, usos y consideraciones
- Principio de funcionamiento y aplicaciones del electrodo de referencia AgAgCl
- Cómo elegir el electrodo de referencia adecuado para su aplicación
- Electrodos de referencia: Calomel, cloruro de plata y sulfato de mercurio - Guía completa















