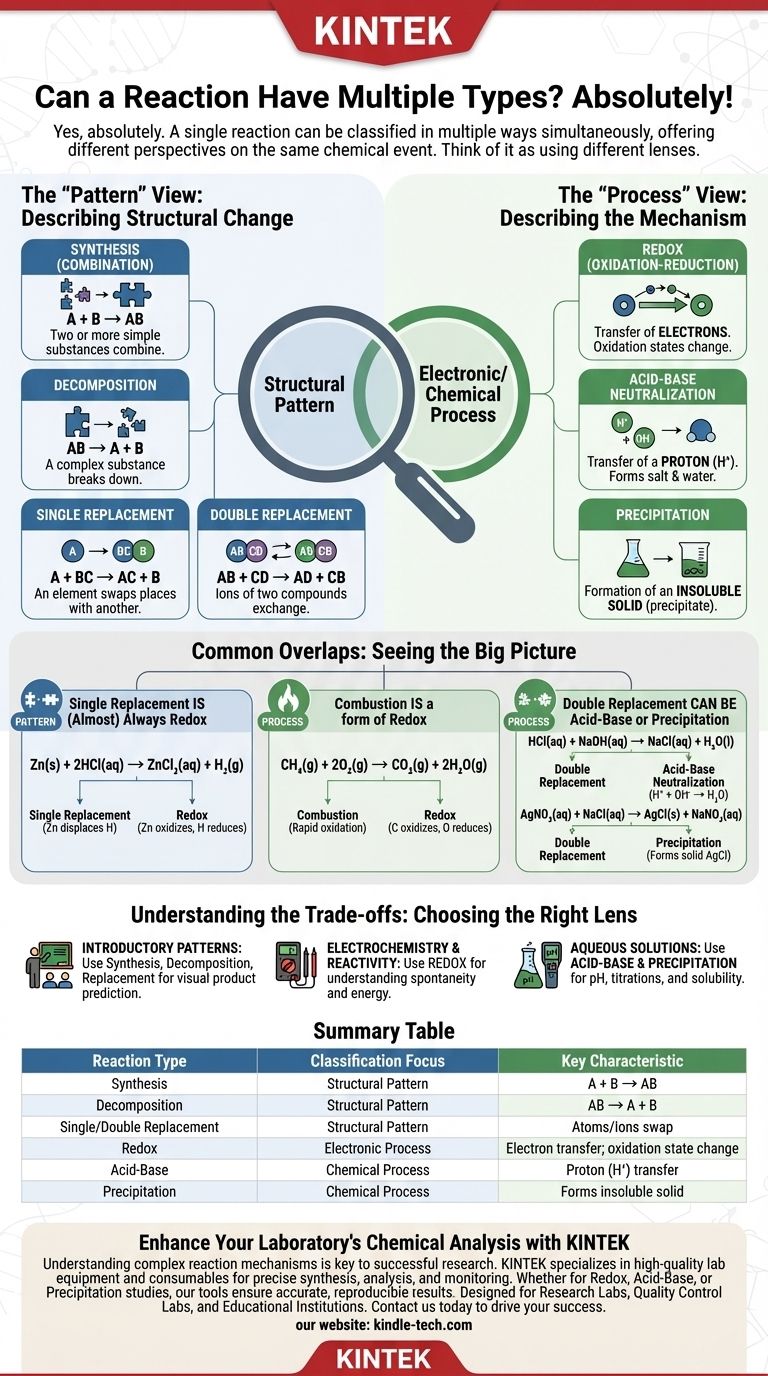
Sí, absolutamente. Una única reacción química a menudo puede clasificarse como de múltiples tipos de reacción simultáneamente. Este es un punto común de confusión porque la química introductoria a menudo presenta los tipos de reacción como categorías mutuamente excluyentes, pero una comprensión más avanzada revela que son simplemente diferentes lentes para analizar el mismo evento químico.
La clave es entender que algunos tipos de reacción describen el patrón estructural de cómo se reorganizan los átomos (como la síntesis o la descomposición), mientras que otros describen el proceso electrónico o químico subyacente (como redox o ácido-base). Una única reacción puede exhibir tanto un patrón específico como un proceso específico.

Por qué las etiquetas simples no son suficientes
La forma en que clasificamos las reacciones depende de lo que queremos entender sobre ellas. Las categorías simples que se aprenden primero son útiles para reconocer patrones visuales, pero no siempre explican el cambio químico fundamental.
La "vista de patrón": descripción del cambio estructural
Al principio de su educación en química, aprende a reconocer las reacciones por cómo los reactivos forman productos. Estas categorías describen la "forma" general de la transformación.
Los principales tipos basados en patrones son:
- Síntesis (o Combinación): Dos o más sustancias simples se combinan para formar un producto más complejo (
A + B → AB). - Descomposición: Una sustancia compleja se descompone en otras más simples (
AB → A + B). - Sustitución simple: Un elemento intercambia lugares con otro en un compuesto (
A + BC → AC + B). - Sustitución doble: Los iones de dos compuestos intercambian lugares para formar dos nuevos compuestos (
AB + CD → AD + CB).
Estas etiquetas son excelentes para predecir rápidamente productos basándose en un patrón familiar.
La "vista de proceso": descripción del mecanismo
Clasificaciones más sofisticadas describen cómo ocurre la transformación a nivel molecular o electrónico. Se centran en el proceso fundamental que impulsa la reacción.
Los principales tipos basados en procesos incluyen:
- Redox (Oxidación-Reducción): Este tipo implica la transferencia de electrones. Los estados de oxidación de uno o más elementos cambian durante la reacción.
- Neutralización ácido-base: Un ácido y una base reaccionan, típicamente involucrando la transferencia de un protón (ion H⁺) para formar una sal y agua.
- Precipitación: Se mezclan dos soluciones acuosas y se forma un sólido insoluble (un precipitado).
Estas etiquetas son esenciales para comprender las fuerzas impulsoras subyacentes de una reacción.
Superposiciones comunes que encontrará
Ver cómo se superponen estas categorías es la mejor manera de consolidar su comprensión. La mayoría de las reacciones que encuentre tendrán más de una etiqueta válida.
La sustitución simple es (casi) siempre redox
Considere la reacción del zinc metálico con ácido clorhídrico:
Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
Esta es una reacción clásica de sustitución simple porque el zinc desplaza al hidrógeno. Sin embargo, también es una reacción redox porque los estados de oxidación cambian: el zinc se oxida (de 0 a +2) y el hidrógeno se reduce (de +1 a 0).
La combustión es una forma de redox
La combustión del metano es un buen ejemplo:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Aunque a esto lo llamamos combustión, también es fundamentalmente una reacción redox. El carbono se oxida (de -4 a +4) y el oxígeno se reduce (de 0 a -2).
La sustitución doble puede ser ácido-base o precipitación
Considere la neutralización del ácido clorhídrico con hidróxido de sodio:
HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l)
Esta es una reacción de sustitución doble; Na⁺ y H⁺ intercambian lugares. Más importante aún, es el ejemplo definitivo de una neutralización ácido-base.
De manera similar, al mezclar nitrato de plata y cloruro de sodio:
AgNO₃(aq) + NaCl(aq) → AgCl(s) + NaNO₃(aq)
Esto encaja en el patrón de sustitución doble, pero su característica más notable es la formación de un sólido, lo que la convierte en una reacción de precipitación.
Comprender las compensaciones: el propósito de la clasificación
Elegir una etiqueta no se trata de encontrar la única respuesta "correcta". Se trata de usar la etiqueta más descriptiva y útil para su objetivo específico.
La limitación de los patrones simples
Clasificar una reacción como de "sustitución simple" le dice lo que les sucedió a los átomos, pero no explica por qué sucedió. No explica por qué el zinc reacciona con HCl pero el cobre no.
El poder de las etiquetas mecanicistas
Identificar esa misma reacción como "redox" proporciona una visión mucho más profunda. Permite usar conceptos como series de actividad o potenciales de electrodo estándar para predecir si la reacción ocurrirá espontáneamente y para cuantificar la energía involucrada. La etiqueta redox explica el "porqué".
Tomar la decisión correcta para su objetivo
Utilice la clasificación que mejor se adapte a su propósito. El objetivo no es encontrar una única etiqueta exclusiva, sino aplicar la más relevante.
- Si su enfoque principal es reconocer patrones básicos en un curso introductorio: Cíñase a la síntesis, la descomposición y la sustitución simple/doble para predecir productos visualmente.
- Si su enfoque principal es la electroquímica o la predicción de la reactividad: La clasificación redox es la lente más importante a utilizar.
- Si su enfoque principal es trabajar con soluciones acuosas, pH y titulaciones: Clasificar las reacciones como ácido-base o precipitación será el enfoque más útil.
En última instancia, usar la etiqueta correcta depende de la pregunta específica que esté tratando de responder sobre la transformación química.
Tabla resumen:
| Tipo de reacción | Enfoque de clasificación | Característica clave |
|---|---|---|
| Síntesis | Patrón estructural | Dos o más reactivos se combinan en un producto (A + B → AB) |
| Descomposición | Patrón estructural | Un compuesto se descompone en sustancias más simples (AB → A + B) |
| Sustitución simple/doble | Patrón estructural | Átomos o iones se intercambian entre compuestos |
| Redox | Proceso electrónico | Implica transferencia de electrones; los estados de oxidación cambian |
| Ácido-Base | Proceso químico | Implica transferencia de protón (H⁺) |
| Precipitación | Proceso químico | Formación de un sólido insoluble a partir de soluciones acuosas |
Mejore el análisis químico de su laboratorio con KINTEK
Comprender los mecanismos de reacción complejos es clave para el éxito de la investigación y el desarrollo. En KINTEK, nos especializamos en proporcionar equipos de laboratorio y consumibles de alta calidad que respaldan la síntesis química, el análisis y el monitoreo de procesos precisos. Ya sea que esté trabajando en reacciones redox, titulaciones ácido-base o estudios de precipitación, nuestras herramientas confiables lo ayudan a lograr resultados precisos y reproducibles.
Nuestros productos están diseñados para:
- Laboratorios de investigación que requieren un control preciso de la temperatura para reacciones de síntesis y descomposición.
- Laboratorios de control de calidad que necesitan equipos consistentes para análisis ácido-base y de precipitación.
- Instituciones educativas que buscan aparatos duraderos y fáciles de usar para la enseñanza de tipos de reacción fundamentales y avanzados.
Deje que KINTEK sea su socio de confianza para avanzar en las capacidades de su laboratorio. Contáctenos hoy para analizar sus necesidades específicas y descubrir cómo nuestras soluciones pueden impulsar su éxito.
Guía Visual
Productos relacionados
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Reactor de Presión de Laboratorio Autoclave de Alta Presión de Acero Inoxidable
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Circulador de Calentamiento de Temperatura Constante de Alta Temperatura, Baño de Agua, Enfriador, Circulador para Baño de Reacción
- Molino de Molienda de Tejidos Híbrido de Laboratorio
La gente también pregunta
- ¿Por qué es necesaria la lubricación en las bombas de paletas rotativas? Esencial para el sellado, la refrigeración y la longevidad
- ¿Cuáles son las precauciones de seguridad para los experimentos con calor? Pasos esenciales para prevenir quemaduras y accidentes en el laboratorio
- ¿Cuáles son las aplicaciones del endurecimiento por haz de electrones? Logre un endurecimiento de precisión para componentes críticos
- ¿Cómo funciona el proceso de sinterización? Transformar el polvo en piezas densas y de alto rendimiento
- ¿Para qué se utiliza el aceite de pirólisis? Desbloqueando energía renovable a partir de residuos
- ¿Cómo contribuye un horno de secado de laboratorio a la síntesis de TiO2? Desbloquee la estabilidad avanzada de materiales y la unión química
- ¿Cuáles son las aplicaciones de la pulverización catódica por haz de iones? Logre una calidad de película delgada inigualable para aplicaciones exigentes
- ¿Cuál es la función de un agitador magnético de laboratorio en el proceso de degradación fotocatalítica?






