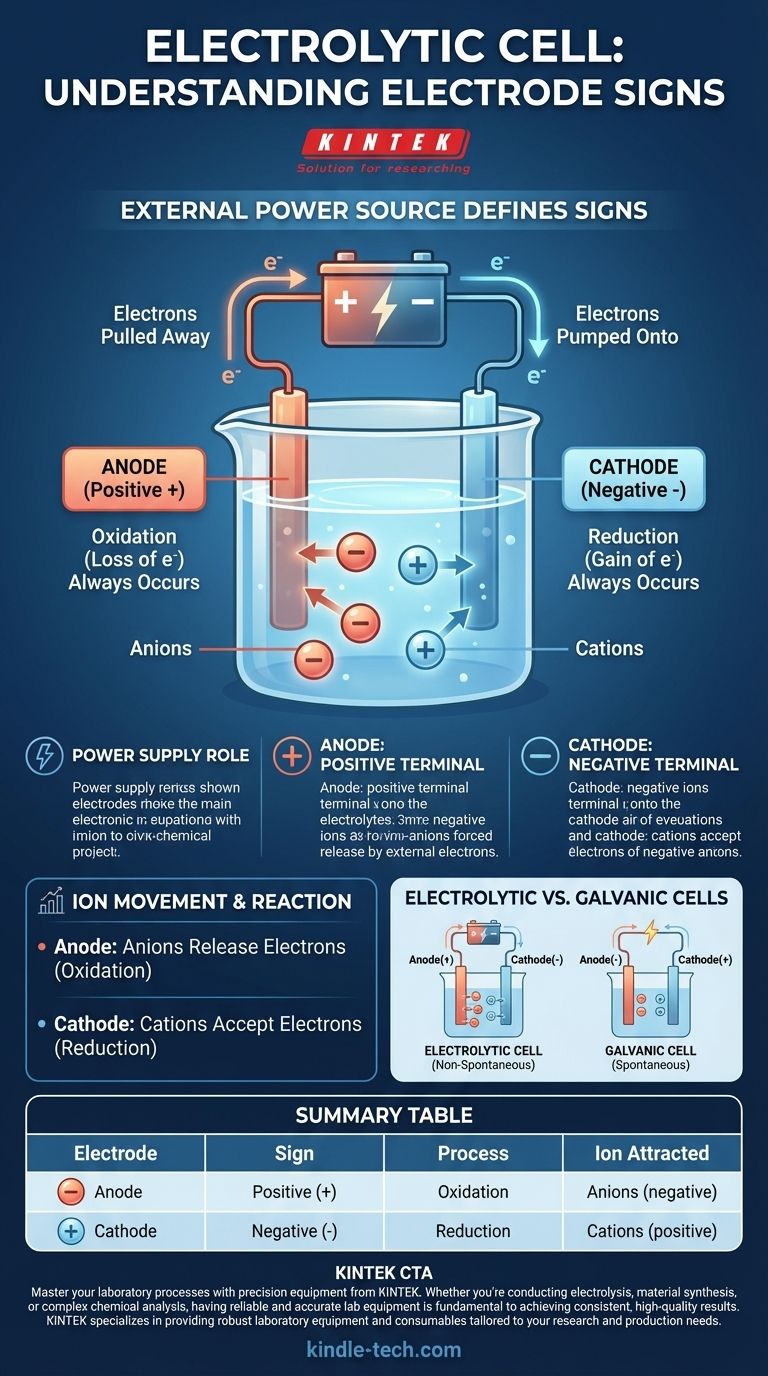
En una celda electrolítica, la convención de signos se define por la fuente de energía externa. El ánodo se le asigna un signo positivo (+), y el cátodo se le asigna un signo negativo (-). Esto se debe a que se aplica un voltaje externo para impulsar una reacción química que no ocurriría espontáneamente.
La clave para entender una celda electrolítica es reconocer que no es un sistema autónomo. Los signos de sus electrodos están dictados enteramente por la fuente de alimentación externa a la que está conectada, forzando que ocurra un cambio químico no espontáneo.

Por qué una fuente de energía externa define los signos
Una celda electrolítica utiliza energía eléctrica para crear energía química. Este proceso, conocido como electrólisis, requiere una fuerza externa —una batería o una fuente de alimentación de corriente continua— para iniciar y mantener la reacción.
El papel de la fuente de alimentación
La fuente de alimentación actúa como una "bomba de electrones". Extrae electrones de un electrodo y los empuja hacia el otro, creando un desequilibrio de carga que obliga a los iones en la solución electrolítica a reaccionar.
El ánodo está conectado al terminal positivo
El terminal positivo de la fuente de alimentación externa está conectado al ánodo. Este terminal extrae activamente electrones del ánodo, dejándolo con una carga neta positiva.
El cátodo está conectado al terminal negativo
Por el contrario, el terminal negativo de la fuente de alimentación está conectado al cátodo. Este terminal bombea activamente electrones hacia el cátodo, dándole un exceso de electrones y una carga neta negativa.
Cómo el movimiento de iones crea la reacción
Las cargas forzadas en los electrodos son las que atraen a los iones disueltos en el electrolito, obligándolos a moverse y reaccionar. Las definiciones fundamentales de oxidación y reducción permanecen constantes.
Ánodo: El sitio de oxidación (siempre)
Independientemente del tipo de celda, la oxidación (la pérdida de electrones) siempre ocurre en el ánodo. En una celda electrolítica, los iones cargados negativamente (aniones) son atraídos al ánodo positivo, donde liberan su exceso de electrones y se oxidan.
Cátodo: El sitio de reducción (siempre)
De manera similar, la reducción (la ganancia de electrones) siempre ocurre en el cátodo. Los iones cargados positivamente (cationes) en la solución son atraídos al cátodo negativo, donde aceptan el exceso de electrones y se reducen.
Una distinción crítica: celdas electrolíticas vs. galvánicas
Una fuente principal de confusión surge al comparar las celdas electrolíticas con las celdas galvánicas (o voltaicas), como una batería estándar. Sus convenciones de signos son opuestas por una razón muy específica.
Reacciones espontáneas vs. no espontáneas
Una celda galvánica funciona con una reacción química espontánea que produce energía eléctrica. Aquí, el ánodo es la fuente natural de electrones, lo que lo hace negativo, y el cátodo es donde se consumen, lo que lo hace positivo.
Una celda electrolítica ejecuta una reacción no espontánea que consume energía eléctrica. La fuente de energía externa invierte la polaridad natural para forzar que la reacción proceda.
La constante universal
A pesar de la diferencia en los signos, los procesos centrales son los mismos en ambos tipos de celdas:
- El ánodo es siempre el sitio de oxidación.
- El cátodo es siempre el sitio de reducción.
Cómo recordar los signos
Utilice estos principios para mantener claras las convenciones según su objetivo.
- Si su enfoque principal es identificar los terminales: Recuerde que en una celda electrolítica, los signos coinciden con la fuente de alimentación externa: el ánodo es positivo y el cátodo es negativo.
- Si su enfoque principal es rastrear los iones: Siga la regla simple de cargas opuestas: los aniones negativos se mueven al ánodo positivo, y los cationes positivos se mueven al cátodo negativo.
- Si su enfoque principal es distinguir los tipos de celdas: Asocie "electrolítica" con una fuente de energía externa que fuerza una carga positiva en el ánodo y una carga negativa en el cátodo para impulsar la reacción.
En última instancia, los signos de una celda electrolítica son una consecuencia directa de una fuente de energía externa que anula el flujo natural de una reacción química.
Tabla resumen:
| Electrodo | Signo | Proceso | Ion atraído |
|---|---|---|---|
| Ánodo | Positivo (+) | Oxidación | Aniones (negativos) |
| Cátodo | Negativo (-) | Reducción | Cationes (positivos) |
Domine sus procesos de laboratorio con equipos de precisión de KINTEK.
Ya sea que esté realizando electrólisis, síntesis de materiales o análisis químicos complejos, contar con equipos de laboratorio confiables y precisos es fundamental para lograr resultados consistentes y de alta calidad. KINTEK se especializa en proporcionar equipos y consumibles de laboratorio robustos adaptados a sus necesidades de investigación y producción.
Contacte a nuestros expertos hoy para discutir cómo nuestras soluciones pueden impulsar sus innovaciones y mejorar la eficiencia de los flujos de trabajo de su laboratorio.
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda Electrolítica Electroquímica de Baño de Agua de Doble Capa
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electroquímica de baño de agua óptico electrolítico
La gente también pregunta
- ¿Cómo se pueden prevenir las fugas al usar una celda electrolítica de baño de agua de cinco puertos? Asegure una Configuración Electroquímica Confiable y Segura
- ¿Cómo se debe operar la celda electrolítica de baño de agua de cinco puertos durante un experimento? Domine el control preciso para obtener resultados fiables
- ¿Cuál es la forma correcta de manejar una celda electrolítica de baño de agua de cinco puertos? Asegure experimentos electroquímicos precisos y seguros
- ¿Cómo se debe limpiar la celda electrolítica de baño de agua de cinco puertos para su mantenimiento? Una guía paso a paso para resultados fiables
- ¿Cuáles son los componentes estándar de la celda electrolítica de baño de agua de cinco puertos? Domine el instrumento de precisión para el análisis electroquímico



















