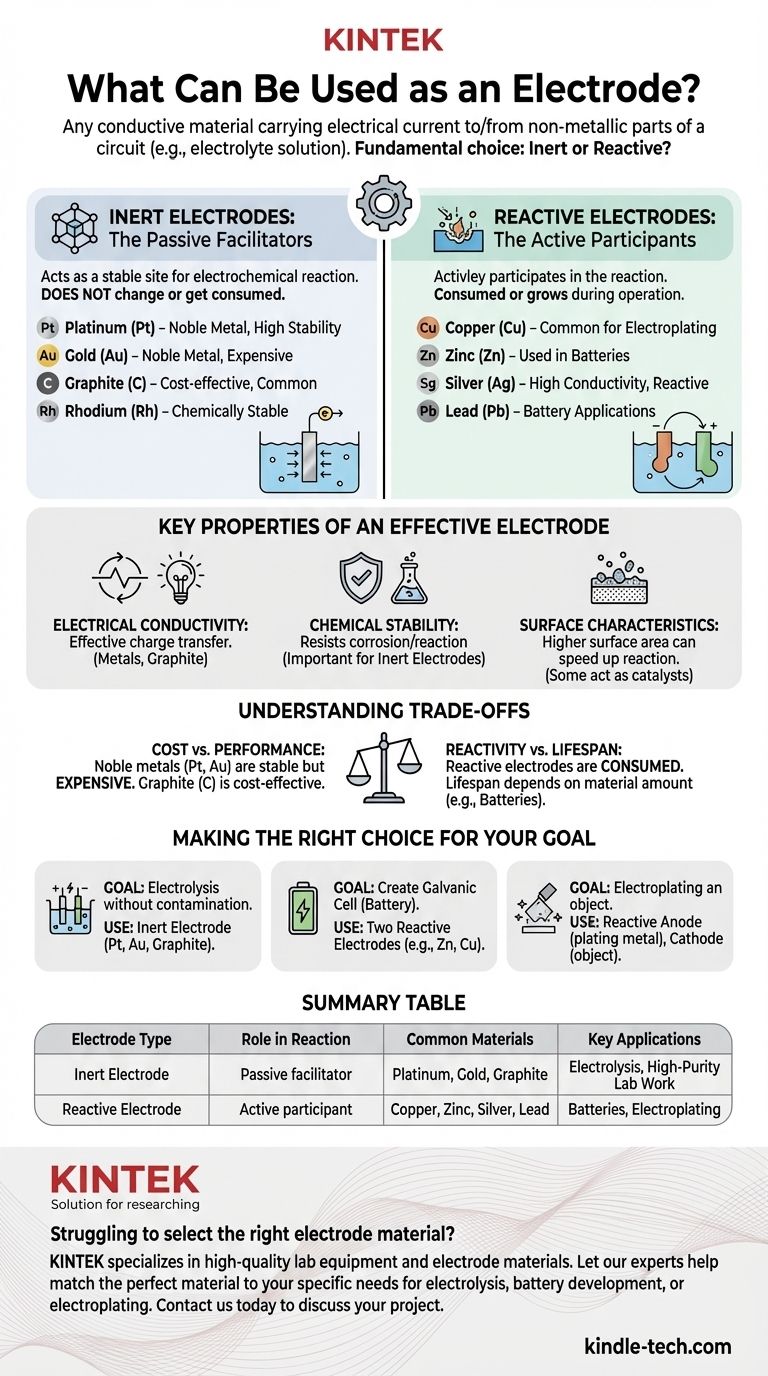
En resumen, un electrodo es cualquier material conductor que transporta una corriente eléctrica hacia o desde una parte no metálica de un circuito, como una solución electrolítica. Los electrodos se clasifican ampliamente en dos categorías: electrodos inertes, que no participan en la reacción química, y electrodos reactivos, que sí lo hacen. Ejemplos comunes incluyen metales como platino, oro, cobre y zinc, así como no metales como el grafito (carbono).
Elegir un electrodo es una decisión de diseño crítica en cualquier sistema electroquímico. La elección fundamental no es solo "qué material conduce la electricidad", sino si se necesita un material que permanezca inalterado (inerte) o uno que participe activamente en la reacción química (reactivo).

Los dos tipos fundamentales de electrodos
La distinción más importante al seleccionar un material para electrodos es su papel en la reacción química deseada. Esto separa todos los materiales potenciales en dos grupos principales.
Electrodos inertes: los facilitadores pasivos
Un electrodo inerte actúa como un sitio estable y no reactivo para que ocurra una reacción electroquímica. Su función es simplemente conducir electrones hacia o desde el electrolito.
El material en sí no cambia, no se consume ni se disuelve en la solución. Es meramente una superficie.
Debido a esto, los electrodos inertes deben estar hechos de materiales que sean químicamente estables en el electrolito específico que se utiliza. Las opciones comunes incluyen metales nobles y carbono.
Ejemplos de electrodos inertes:
- Platino (Pt)
- Oro (Au)
- Grafito (C)
- Rodio (Rh)
Electrodos reactivos: los participantes activos
Un electrodo reactivo es un participante activo en la reacción electroquímica. Se oxida (disolviéndose en el electrolito) o es el producto de la reducción (depositándose en la superficie).
Estos materiales se eligen específicamente por su capacidad de reaccionar de forma controlada. Este es el principio detrás de las baterías y la galvanoplastia.
El electrodo en sí se consume o crece durante el funcionamiento de la celda electroquímica.
Ejemplos de electrodos reactivos:
- Cobre (Cu)
- Zinc (Zn)
- Plata (Ag)
- Plomo (Pb)
Propiedades clave de un electrodo eficaz
Más allá de la clasificación básica, varias propiedades determinan qué tan bien funcionará un material como electrodo para un propósito específico.
Conductividad eléctrica
Este es el requisito más fundamental. El material debe ser un conductor eficaz de electricidad para transferir carga entre el circuito externo y el electrolito. Los metales y el grafito son excelentes opciones por esta razón.
Estabilidad química
Para que un electrodo se considere inerte, debe resistir la corrosión o la reacción con el electrolito y cualquier sustancia producida durante la reacción. Por eso, los metales nobles como el platino y el oro son muy valorados para estas aplicaciones.
Características de la superficie
La reacción ocurre en la superficie del electrodo. Un material con una mayor área de superficie a menudo puede soportar una velocidad de reacción más rápida. Además, algunos materiales, como el platino, pueden actuar como catalizadores, disminuyendo la energía requerida para que una reacción proceda.
Comprendiendo las compensaciones
El electrodo teóricamente "mejor" no siempre es el más práctico de usar. Las aplicaciones del mundo real requieren equilibrar el rendimiento con otros factores.
Costo vs. Rendimiento
Los metales nobles como el platino y el oro son electrodos inertes excepcionales debido a su extrema estabilidad, pero son muy caros.
Para muchas aplicaciones, el grafito ofrece una alternativa mucho más rentable. Aunque puede ser menos duradero o catalíticamente activo que el platino, su bajo costo lo convierte en la opción dominante para innumerables procesos industriales.
Reactividad vs. Vida útil
Por definición, los electrodos reactivos se consumen con el tiempo. Esta es una función necesaria en aplicaciones como las celdas galvánicas (baterías), donde el consumo del electrodo genera la corriente eléctrica.
Esto significa que la vida útil del dispositivo está directamente ligada a la cantidad de material de electrodo reactivo disponible. La elección del material dicta el voltaje de la celda y su longevidad.
Tomando la decisión correcta para su objetivo
Su selección de un material de electrodo debe estar impulsada enteramente por el objetivo de su celda electroquímica.
- Si su enfoque principal es la electrólisis sin contaminación: Necesita un electrodo inerte. Use platino u oro para trabajos de laboratorio de alta pureza, o grafito (carbono) como una alternativa rentable.
- Si su enfoque principal es crear una celda galvánica (una batería): Necesita dos electrodos reactivos diferentes. Use materiales como zinc y cobre, cuya diferencia de potencial químico impulsa la corriente eléctrica.
- Si su enfoque principal es la galvanoplastia de un objeto: Su ánodo (electrodo positivo) debe ser un electrodo reactivo hecho del metal que desea chapar (por ejemplo, plata), y su cátodo (electrodo negativo) será el objeto mismo.
En última instancia, el electrodo correcto es aquel cuyas propiedades químicas y físicas se ajustan precisamente a la función específica que debe desempeñar dentro de su celda electroquímica.
Tabla resumen:
| Tipo de electrodo | Función en la reacción | Materiales comunes | Aplicaciones clave |
|---|---|---|---|
| Electrodo inerte | Facilitador pasivo; no reacciona | Platino, Oro, Grafito | Electrólisis, Trabajo de laboratorio de alta pureza |
| Electrodo reactivo | Participante activo; se consume o se forma | Cobre, Zinc, Plata, Plomo | Baterías, Galvanoplastia |
¿Tiene dificultades para seleccionar el material de electrodo adecuado para su aplicación? El rendimiento de su proceso electroquímico depende de esta elección crítica. KINTEK se especializa en proporcionar equipos y consumibles de laboratorio de alta calidad, incluida una amplia gama de materiales para electrodos como platino, grafito y metales reactivos. Nuestros expertos pueden ayudarle a encontrar el material perfecto para sus necesidades específicas, ya sea para electrólisis, desarrollo de baterías o galvanoplastia, asegurando resultados y eficiencia óptimos. Contáctenos hoy para discutir su proyecto y permita que KINTEK sea su socio en precisión. Póngase en contacto a través de nuestro formulario de contacto
Guía Visual
Productos relacionados
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo Electrolítico de Grafito en Disco y Varilla de Grafito
- Electrodo Auxiliar de Platino para Uso en Laboratorio
- Electrodo de Disco de Oro
La gente también pregunta
- ¿Qué comprobaciones deben realizarse en un cepillo de fibra de carbono antes de su uso? Asegure la fiabilidad en los procesos de su laboratorio
- ¿Cómo se debe limpiar un portaelectrodos como parte del mantenimiento regular? Garantizar mediciones electroquímicas fiables
- ¿Cuál es una aplicación común para el electrodo de alambre/varilla de platino? La guía esencial de los contraelectrodos
- ¿Cuál es el entorno de almacenamiento ideal para el soporte de electrodos de PTFE? Proteja la precisión de su laboratorio
- ¿Por qué se prefieren los materiales de alta área superficial para los ánodos de BES? Maximizar la potencia y la eficiencia microbiana
- ¿Por qué es obligatorio un sistema estándar de tres electrodos para las pruebas electroquímicas de corrosión en muestras soldadas?
- ¿Por qué se utiliza comúnmente un alambre de platino como contraelectrodo en la investigación de corrosión de cerámicas de alúmina? Pureza de los datos
- ¿Cuáles son las funciones de los electrodos de alambre de platino helicoidal y de plata/cloruro de plata? Guía experta de pruebas de corrosión