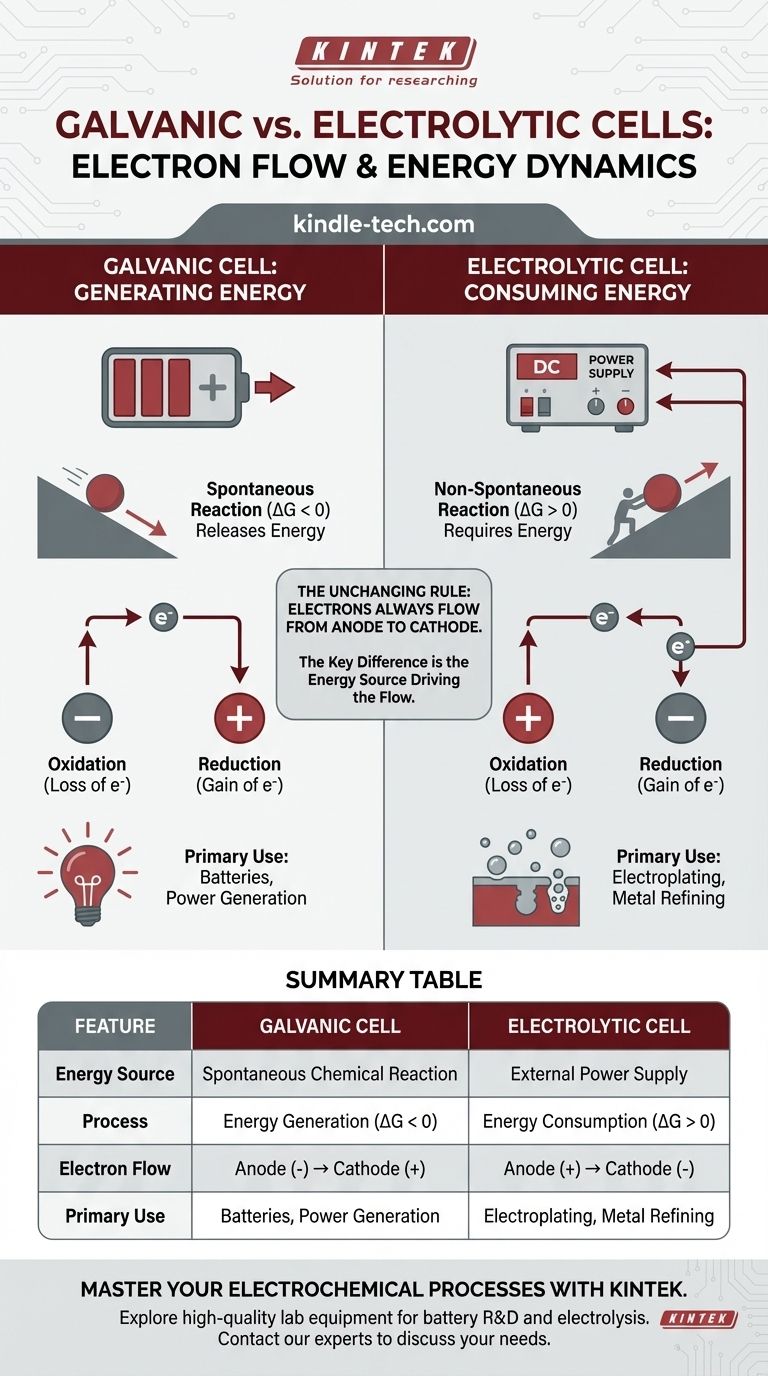
En cualquier célula electroquímica, el flujo de electrones en el circuito externo es siempre del ánodo al cátodo. La distinción crítica radica en por qué fluyen. En una célula galvánica, una reacción química espontánea genera energía e impulsa los electrones. En una célula electrolítica, una fuente de alimentación externa proporciona la energía para forzar el flujo de electrones e impulsar una reacción no espontánea.
La diferencia fundamental no es la dirección del flujo de electrones en relación con la oxidación y la reducción, sino la fuente de energía que impulsa el proceso. Una célula galvánica convierte la energía química almacenada en energía eléctrica, mientras que una célula electrolítica utiliza energía eléctrica externa para forzar un cambio químico.

El Principio Central: Reacciones Espontáneas vs. No Espontáneas
Para comprender el flujo de electrones, primero debes entender la dinámica energética de la célula. Todo el sistema se rige por si la reacción química ocurre por sí sola o si debe forzarse.
Células Galvánicas: Generación de Energía
Una célula galvánica (también llamada célula voltaica) aprovecha una reacción química espontánea. Piénsalo como una pelota rodando cuesta abajo: el proceso libera energía de forma natural.
Esta reacción espontánea tiene una energía libre de Gibbs negativa (ΔG < 0). Esta liberación de energía química se convierte directamente en energía eléctrica, impulsando los electrones desde el ánodo, a través del circuito externo, hasta el cátodo.
Las células galvánicas son la base de todas las baterías convencionales.
Células Electrolíticas: Consumo de Energía
Una célula electrolítica se utiliza para impulsar una reacción química no espontánea. Esto es como empujar una pelota cuesta arriba: requiere una entrada constante de energía externa para que ocurra.
Esta reacción tiene una energía libre de Gibbs positiva (ΔG > 0). Una fuente de alimentación externa, como una batería o una fuente de alimentación, actúa como una "bomba de electrones". Fuerza a los electrones hacia el cátodo y los extrae del ánodo, impulsando una reacción que no ocurriría por sí sola.
Deconstruyendo el Flujo de Electrones y la Polaridad de los Electrodos
La confusión sobre el flujo de electrones a menudo surge de la polaridad cambiante de los electrodos. Si bien los roles de ánodo y cátodo son fijos, sus cargas no lo son.
La Regla Inmutable: Del Ánodo al Cátodo
Por definición, el sitio de la oxidación (pérdida de electrones) es siempre el ánodo, y el sitio de la reducción (ganancia de electrones) es siempre el cátodo.
Debido a que los electrones se pierden en el ánodo y se ganan en el cátodo, los electrones en el cable externo siempre fluyen del ánodo al cátodo. Esta es una constante universal para ambos tipos de células.
La Diferencia Crítica: Carga del Electrodo
La polaridad (la carga positiva o negativa) de los electrodos se invierte entre los dos tipos de células, lo que es la fuente de la mayor confusión.
En una célula galvánica, el ánodo es el sitio de la oxidación espontánea que libera electrones. Esta acumulación de carga negativa convierte al ánodo en el terminal negativo (-). El cátodo, que consume electrones, se convierte en el terminal positivo (+).
En una célula electrolítica, la fuente de alimentación externa dicta la polaridad. Conecta su terminal negativo al cátodo de la célula para forzar los electrones hacia él e impulsar la reducción. Conecta su terminal positivo al ánodo de la célula para extraer electrones e impulsar la oxidación.
- Célula Galvánica: Ánodo (-) → Cátodo (+)
- Célula Electrolítica: Ánodo (+) → Cátodo (-)
Comprensión de las Aplicaciones Prácticas
La diferencia fundamental en la conversión de energía determina cómo se utilizan estas células. Una produce energía y la otra la consume para producir materiales valiosos.
Células Galvánicas: Energía Bajo Demanda
El principal beneficio de una célula galvánica es su capacidad para actuar como fuente portátil de energía eléctrica.
Son la base de las baterías, desde las pilas AA simples hasta la batería de un automóvil. Su principal limitación es que los reactivos químicos se consumen finalmente, lo que provoca que el voltaje disminuya y la batería se agote.
Células Electrolíticas: Forzando el Cambio Químico
El propósito de una célula electrolítica es utilizar la electricidad para crear un producto químico.
Este proceso, conocido como electrólisis, es esencial para aplicaciones industriales como el refinado de metales (por ejemplo, la producción de aluminio puro), el recubrimiento de superficies con una capa protectora de metal y la división del agua en hidrógeno y oxígeno. Su inconveniente es la necesidad de un suministro continuo y, a menudo, costoso de energía eléctrica.
Cómo Aplicar Esto a su Objetivo
Su enfoque depende enteramente de si necesita generar electricidad o impulsar una reacción química.
- Si su enfoque principal es generar energía o crear una batería: Está trabajando con una célula galvánica, donde una reacción espontánea produce una corriente eléctrica.
- Si su enfoque principal es purificar un metal, recubrir una superficie o dividir un compuesto: Necesita una célula electrolítica, que utiliza energía externa para impulsar una reacción no espontánea.
- Si su enfoque principal es comprender el principio fundamental: Recuerde que la oxidación siempre está en el ánodo y la reducción en el cátodo; la diferencia clave es si la reacción es espontánea (galvánica) o forzada (electrolítica).
Comprender esta distinción entre la liberación espontánea de energía y la entrada forzada de energía es la clave para dominar las células electroquímicas.
Tabla Resumen:
| Característica | Célula Galvánica | Célula Electrolítica |
|---|---|---|
| Fuente de Energía | Reacción Química Espontánea | Fuente de Alimentación Externa |
| Proceso | Generación de Energía (ΔG < 0) | Consumo de Energía (ΔG > 0) |
| Flujo de Electrones | Ánodo (-) → Cátodo (+) | Ánodo (+) → Cátodo (-) |
| Uso Principal | Baterías, Generación de Energía | Electrochapado, Refinación de Metales |
Domine sus Procesos Electroquímicos con KINTEK
Ya sea que esté desarrollando nuevas tecnologías de baterías o refinando materiales mediante electrólisis, contar con el equipo de laboratorio adecuado es crucial para obtener resultados precisos y confiables. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, proporcionando las herramientas precisas que necesita para toda su investigación y desarrollo electroquímico.
Permítanos ayudarle a equipar su laboratorio para el éxito. Contacte a nuestros expertos hoy mismo para discutir sus necesidades específicas y descubrir cómo KINTEK puede apoyar su trabajo innovador.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Cuáles son las funciones principales de una celda electroquímica personalizada de Teflón? Lograr evaluaciones precisas de electrodos de silicio
- ¿En qué se diferencia la electrodeposición de la deposición electroquímica? Los términos son intercambiables
- ¿Cuáles son las ventajas técnicas de utilizar un recipiente de vidrio de 1 litro y tres electrodos? Optimizar la fidelidad de los datos
- ¿Cómo se pueden prevenir las fugas de agua y gas en una celda electrolítica de doble capa con baño de agua? Una guía para el mantenimiento proactivo
- ¿Cuáles son las precauciones importantes que se deben observar al utilizar la célula electrolítica Raman in-situ? Garantizar la seguridad y la integridad de los datos
- ¿Cuál es la necesidad de un sistema de prueba electroquímica a temperatura constante? Garantizar la precisión en la investigación de perovskitas
- ¿Qué es una celda electrolítica? Una guía para forzar reacciones químicas con electricidad
- ¿Cuál es la instrucción principal de manipulación para la celda electrolítica tipo H? Cuidado Esencial para Equipos de Laboratorio de Vidrio



















