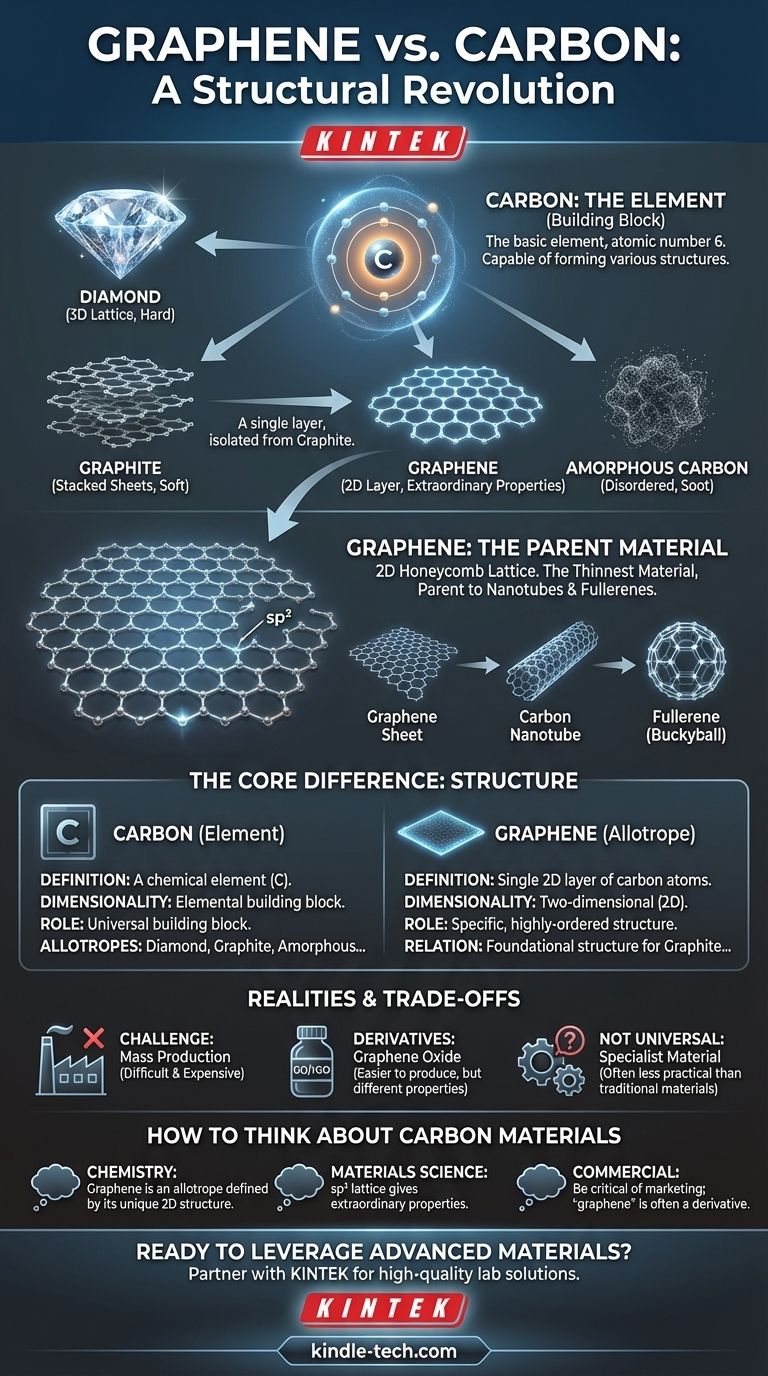
La diferencia fundamental no es de sustancia, sino de estructura. El grafeno no es un material diferente al carbono; es una forma específica y bidimensional del elemento carbono. Mientras que el carbono es el elemento básico, el grafeno es una capa única, de un átomo de espesor, de átomos de carbono dispuestos en una precisa red de panal, y esta disposición única es la fuente de todas sus propiedades extraordinarias.
La distinción central a recordar es que "carbono" es el elemento —el bloque de construcción— mientras que "grafeno" es una estructura específica y altamente ordenada construida exclusivamente a partir de esos bloques. Piense en ello como el diamante y el grafito: ambos son carbono puro, pero sus diferentes disposiciones atómicas les confieren propiedades muy diferentes.

Del Elemento al Alótropo: La Fundación del Carbono
Para comprender el papel del grafeno, primero debemos entender la versatilidad de su elemento progenitor, el carbono. Este contexto es esencial para apreciar por qué un simple cambio estructural puede crear un material revolucionario.
Carbono: El Bloque de Construcción Universal
El carbono es un elemento (número atómico 6) que se encuentra en la tabla periódica. Su característica definitoria es su capacidad para formar fuertes enlaces covalentes consigo mismo y con muchos otros elementos, creando un vasto número de compuestos.
En su forma elemental, el carbono puede existir en varias configuraciones estructurales diferentes.
El Concepto de Alótropos
Estas diferentes formas estructurales de un solo elemento se denominan alótropos. Los átomos son idénticos, pero su disposición en el espacio es diferente, lo que da lugar a propiedades físicas y químicas drásticamente distintas.
El ejemplo clásico es la relación entre el grafito blando y gris utilizado en los lápices y el diamante duro y transparente utilizado en la joyería. Ambos son carbono puro, pero sus propiedades divergen por completo debido a su estructura atómica.
Alótropos Comunes del Carbono
El grafeno es solo uno de varios alótropos de carbono importantes. Los principales incluyen:
- Diamante: Los átomos de carbono se disponen en una red tetraédrica rígida y tridimensional. Esto lo hace increíblemente duro.
- Grafito: Los átomos de carbono se disponen en láminas de una red hexagonal, que se apilan unas sobre otras. Estas capas pueden deslizarse fácilmente, haciendo que el grafito sea blando.
- Grafeno: Una capa única y aislada de la red hexagonal que constituye el grafito.
- Carbono Amorfo: Una forma, como el hollín o el carbón vegetal, donde los átomos de carbono no tienen un orden cristalino de largo alcance.
¿Qué Hace del Grafeno una Forma Única de Carbono?
La fama del grafeno proviene de ser la expresión más pura del potencial bidimensional del carbono. Es la estructura fundamental para otros alótropos.
Un Material Verdaderamente Bidimensional
La característica definitoria del grafeno es que es una capa atómica única. Con solo un átomo de espesor, es el material más delgado jamás creado, un verdadero plano 2D de átomos.
La Red de Panal
Los átomos de carbono en el grafeno están unidos por enlaces sp², formando un patrón hexagonal perfectamente repetitivo, muy parecido a un panal de abejas o una malla de alambre. Esta estructura plana y fuertemente unida es la fuente de su notable estabilidad y resistencia.
El Progenitor de Otros Materiales
Comprender el grafeno aclara su relación con otras formas de carbono. Se puede pensar en el grafito como simplemente una pila de innumerables láminas de grafeno. Además, conceptualmente se puede enrollar una lámina de grafeno para formar un nanotubo de carbono o envolverla en una esfera para formar un fullereno (buckyball).
Comprensión de las Compensaciones y Realidades Prácticas
Aunque las propiedades del grafeno son extraordinarias, su aplicación en el mundo real está limitada por importantes desafíos prácticos. Reconocer estas limitaciones es clave para una comprensión objetiva.
El Desafío de la Producción en Masa
Producir láminas grandes y sin defectos de grafeno prístino es extremadamente difícil y costoso. El famoso "método de cinta adhesiva" utilizado para su descubrimiento (despegando capas del grafito) no es escalable para uso industrial.
"Grafeno" frente a Derivados del Grafeno
Muchos productos comercializados como que contienen "grafeno" en realidad utilizan materiales relacionados como el óxido de grafeno (GO) o el óxido de grafeno reducido (rGO). Estos son más fáciles y baratos de producir a granel, pero tienen propiedades eléctricas y mecánicas diferentes, y a menudo inferiores, en comparación con el grafeno puro.
No es una Solución Universal
El grafeno es un material especializado. Aunque es más fuerte que el acero y más conductor que el cobre, su coste y las dificultades de integración hacen que los materiales tradicionales sigan siendo más prácticos y rentables para la gran mayoría de las aplicaciones.
Cómo Pensar en los Materiales de Carbono
Su perspectiva sobre la relación carbono-grafeno depende de su objetivo. Utilice estos puntos para enmarcar su pensamiento.
- Si su enfoque principal es la química fundamental: Recuerde que el grafeno es un alótropo del elemento carbono, definido por su estructura única de panal 2D.
- Si su enfoque principal es la ciencia de los materiales: Concéntrese en cómo la red unida por
sp²del grafeno da lugar a propiedades extraordinarias —resistencia, conductividad y ligereza— que son fundamentalmente diferentes de los alótropos 3D como el diamante. - Si su enfoque principal son los productos comerciales: Sea crítico con las afirmaciones de marketing y comprenda que el "grafeno" utilizado es a menudo un derivado, donde el desafío radica en lograr una producción rentable a escala.
En última instancia, reconocer la diferencia entre el carbono como elemento y el grafeno como estructura es la clave para comprender una nueva clase de materiales diseñados a nivel atómico.
Tabla de Resumen:
| Característica | Carbono (Elemento) | Grafeno (Alótropo) |
|---|---|---|
| Definición | Un elemento químico (C) | Una sola capa de átomos de carbono en una red de panal 2D |
| Dimensionalidad | N/A (Bloque de construcción elemental) | Bidimensional (2D) |
| Alótropos Clave | Diamante, Grafito, Carbono Amorfo | La estructura fundamental del Grafito, Nanotubos de Carbono |
| Distinción Principal | El bloque de construcción universal | Una estructura específica y altamente ordenada hecha de átomos de carbono |
¿Listo para aprovechar los materiales avanzados en su investigación?
Comprender los matices de materiales como el grafeno es clave para la innovación. En KINTEK, nos especializamos en proporcionar el equipo de laboratorio y los consumibles de alta calidad que necesita para superar los límites de la ciencia de los materiales. Ya sea que esté trabajando con alótropos de carbono u otros materiales avanzados, nuestros productos respaldan la precisión, la fiabilidad y el descubrimiento.
Deje que KINTEK sea su socio en la investigación. Contacte con nuestros expertos hoy mismo para encontrar las soluciones perfectas para los desafíos únicos de su laboratorio.
Guía Visual
Productos relacionados
- Mezclador de laboratorio Vortex, agitador orbital, mezclador multifuncional de rotación y oscilación
- Molino de Molienda de Tejidos Híbrido de Laboratorio
- Homogeneizador de Alto Cizallamiento para Aplicaciones Farmacéuticas y Cosméticas
- Fabricante de piezas personalizadas de PTFE Teflon para tamiz F4 de malla de PTFE
- Máquina automática de prensa térmica de laboratorio
La gente también pregunta
- ¿Cuál es el espesor de la deposición física de vapor? Una guía para optimizar el rendimiento de su recubrimiento
- ¿Qué productos químicos muestran deposición? Una guía de materiales PVD y CVD para su aplicación
- ¿Cuáles son los materiales para las tecnologías de película delgada? Elija el material adecuado para su aplicación
- ¿Cuáles son las técnicas de caracterización del grafeno? Una guía para el control de calidad y el análisis
- ¿Cuál es la estructura y las propiedades de los nanotubos de carbono? Desbloqueando el potencial de los alótropos de carbono 1D
- ¿Qué es el método de síntesis de grafeno de arriba hacia abajo? Una guía para la producción escalable de grafeno
- ¿Cuál de las siguientes es una técnica de caracterización de nanotubos de carbono? Comprenda la diferencia clave entre la fabricación y la medición
- ¿Cómo funcionan los blancos de pulverización catódica? La base de los recubrimientos de película delgada de alto rendimiento



















