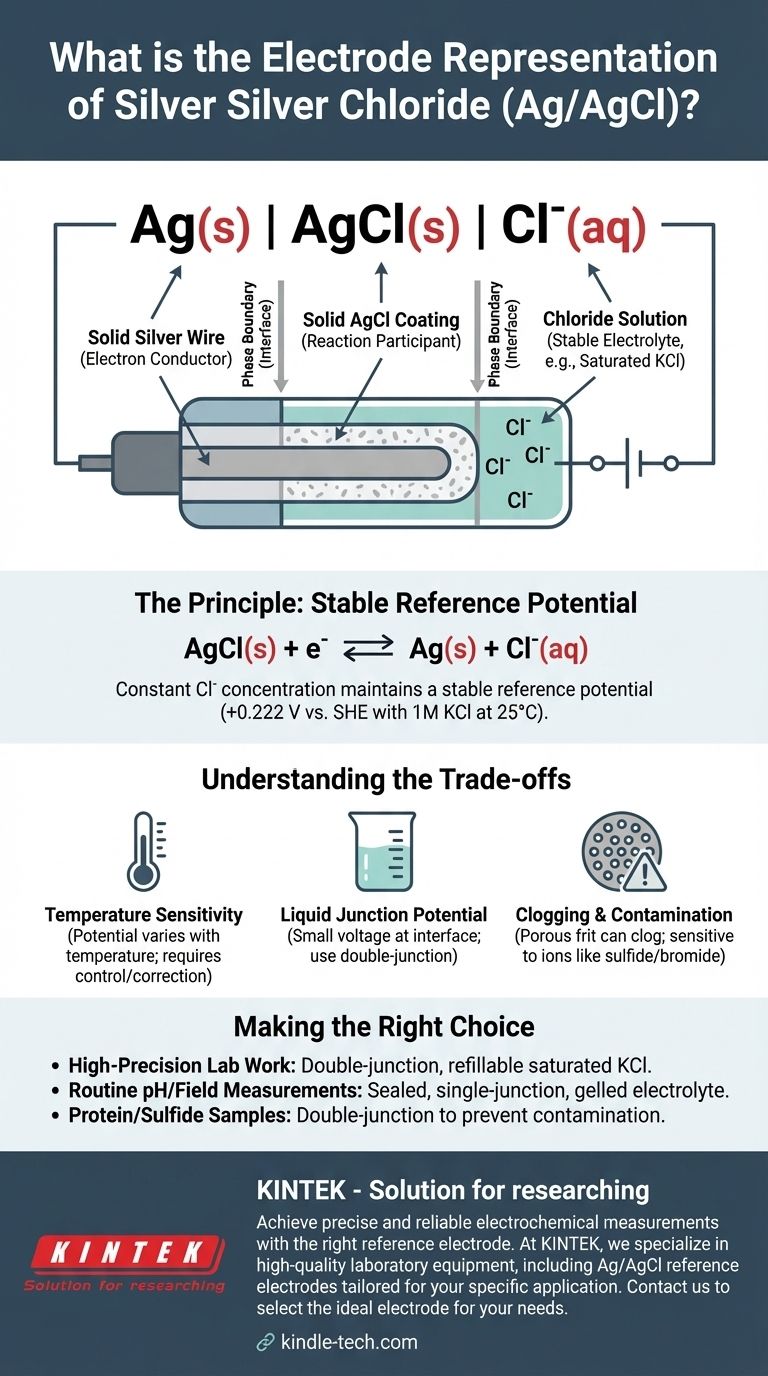
La representación abreviada estándar para un electrodo de plata-cloruro de plata es Ag(s) | AgCl(s) | Cl⁻(aq). Esta notación electroquímica describe las fases físicas y químicas del electrodo, desde el alambre de plata sólido hasta la solución acuosa que contiene iones cloruro. El potencial específico del electrodo depende críticamente de la concentración de estos iones cloruro.
Esta notación es más que una etiqueta técnica; es un esquema para uno de los electrodos de referencia más fiables y comunes en electroquímica. Describe un sistema diseñado para mantener un potencial constante y estable, proporcionando una línea de base fija contra la cual se pueden medir con precisión los potenciales de otros electrodos.

Deconstruyendo la Notación del Electrodo
La representación Ag(s) | AgCl(s) | Cl⁻(aq) detalla la estructura del electrodo de adentro hacia afuera. Cada componente y símbolo tiene un significado preciso.
La Fase Sólida: Ag(s)
Esto representa un alambre de plata sólido. Este alambre sirve como conductor de electrones, conectando el electrodo al circuito de medición externo (un voltímetro o potenciostato).
El Límite de Fase: |
La barra vertical simple | significa un límite de fase. Indica la interfaz donde se encuentran dos estados físicos diferentes, en este caso, el metal de plata sólido y la capa de cloruro de plata sólido.
La Capa de Sal Insoluble: AgCl(s)
Esto denota una capa de cloruro de plata sólido y poco soluble que recubre directamente la superficie del alambre de plata. Esta capa es el corazón de la función del electrodo, participando directamente en la reacción electroquímica.
El Segundo Límite de Fase: |
Una segunda barra vertical marca el límite entre el recubrimiento sólido de cloruro de plata y la solución electrolítica acuosa circundante.
La Solución Electrolítica: Cl⁻(aq)
Esto representa la solución acuosa en la que está sumergido el alambre recubierto. Esta solución debe contener una concentración conocida y constante de iones cloruro (Cl⁻). Típicamente, se utiliza una solución de cloruro de potasio (KCl), a menudo a una concentración específica como 1 M o, más comúnmente, una solución saturada.
El Principio de un Electrodo de Referencia
El electrodo Ag/AgCl es valorado no por su propia reacción, sino por su estabilidad. Proporciona un voltaje constante que actúa como un punto cero fiable para otras mediciones.
La Reacción Reguladora
El potencial estable se establece mediante un equilibrio reversible entre los componentes sólidos y los iones cloruro en la solución. La semirreacción es:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Mientras la concentración (más precisamente, la actividad) de los iones cloruro en la solución se mantenga constante, el potencial de esta semicelda no cambiará.
La Importancia de la Concentración Constante de Cloruro
Usar una solución de KCl saturada asegura que la concentración de Cl⁻ sea constante y reproducible. Si se evapora algo de agua, simplemente se disuelve más sal de KCl para mantener la saturación. Esta es la razón por la cual el potencial de referencia es tan estable. Para una solución de KCl 1M a 25°C (298 K), este potencial es de +0.222 V con respecto al Electrodo Estándar de Hidrógeno (SHE).
Comprender las Compensaciones
Aunque es muy fiable, el electrodo Ag/AgCl no está exento de limitaciones que deben considerarse para un trabajo preciso.
Sensibilidad a la Temperatura
El potencial del electrodo es una función de la temperatura. Para mediciones de alta precisión, la temperatura de la celda debe controlarse o los potenciales medidos deben corregirse por las variaciones de temperatura.
Potencial de Unión Líquida
Cuando la solución de KCl del electrodo entra en contacto con una solución de muestra diferente, se puede desarrollar un pequeño voltaje conocido como potencial de unión líquida en la interfaz. Esto introduce un error pequeño pero sistemático en la medición, que puede minimizarse utilizando un electrodo de doble unión.
Obstrucción y Contaminación
El fritado poroso que permite el contacto eléctrico entre la solución interna y la muestra puede obstruirse. También puede contaminarse por iones en la muestra (como sulfuro, bromuro o yoduro) que pueden reaccionar con la plata, haciendo que el potencial del electrodo varíe con el tiempo.
Tomar la Decisión Correcta para su Medición
Su aplicación dicta qué configuración de electrodo es la mejor.
- Si su enfoque principal es el trabajo de laboratorio de alta precisión: Utilice un electrodo Ag/AgCl de doble unión con una solución de KCl saturada rellenable para minimizar el potencial de unión y permitir un fácil mantenimiento.
- Si su enfoque principal son las mediciones rutinarias de pH o de campo: Un electrodo de unión simple sellado con un electrolito en gel es duradero, de bajo mantenimiento y perfectamente adecuado.
- Si su enfoque principal es el análisis de muestras que contienen proteínas o sulfuros: Debe utilizar un electrodo de doble unión para evitar la obstrucción y la contaminación de la unión de referencia primaria.
Comprender esta notación la transforma de una etiqueta críptica a un esquema funcional para una medición electroquímica fiable.
Tabla Resumen:
| Componente | Símbolo | Descripción |
|---|---|---|
| Alambre de Plata Sólido | Ag(s) | Conductor que se conecta al circuito externo. |
| Recubrimiento de Cloruro de Plata | AgCl(s) | Capa de sal insoluble que permite la reacción reversible. |
| Solución de Iones Cloruro | Cl⁻(aq) | Electrolito acuoso (p. ej., KCl) con concentración constante de Cl⁻. |
| Límite de Fase |
Logre mediciones electroquímicas precisas y fiables con el electrodo de referencia adecuado.
En KINTEK, nos especializamos en equipos de laboratorio de alta calidad, incluida una gama de electrodos de referencia Ag/AgCl adaptados a su aplicación específica, ya requiera modelos de doble unión de alta precisión para trabajos de laboratorio sensibles u opciones duraderas y de bajo mantenimiento para análisis rutinarios.
Nuestros expertos pueden ayudarle a seleccionar el electrodo ideal para garantizar un potencial estable, minimizar errores y mejorar la precisión de su investigación.
Contacte a KINTEK hoy mismo para conversar sobre sus necesidades de laboratorio y descubrir cómo nuestros consumibles y equipos fiables pueden apoyar su trabajo.
Guía Visual
Productos relacionados
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo Electroquímico de Disco Metálico
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo de Disco de Oro
- Electrodo de disco giratorio (disco de anillo) RRDE / compatible con PINE, ALS japonés, Metrohm suizo de carbono vítreo platino
La gente también pregunta
- ¿Qué electrodo se utiliza como referencia? Una guía para mediciones electroquímicas precisas
- ¿Cuáles son las precauciones generales para usar un electrodo de referencia? Asegure potenciales estables para datos precisos
- ¿Qué es el electrodo de referencia de mercurio/sulfato mercuroso? Una guía para la electroquímica sin cloruros
- ¿Cuáles son las características de un electrodo de calomelanos saturado para soluciones neutras? Comprender su estabilidad y limitaciones.
- ¿Qué tipo de electrodo se puede utilizar como punto de referencia? Seleccione el adecuado para mediciones precisas



















