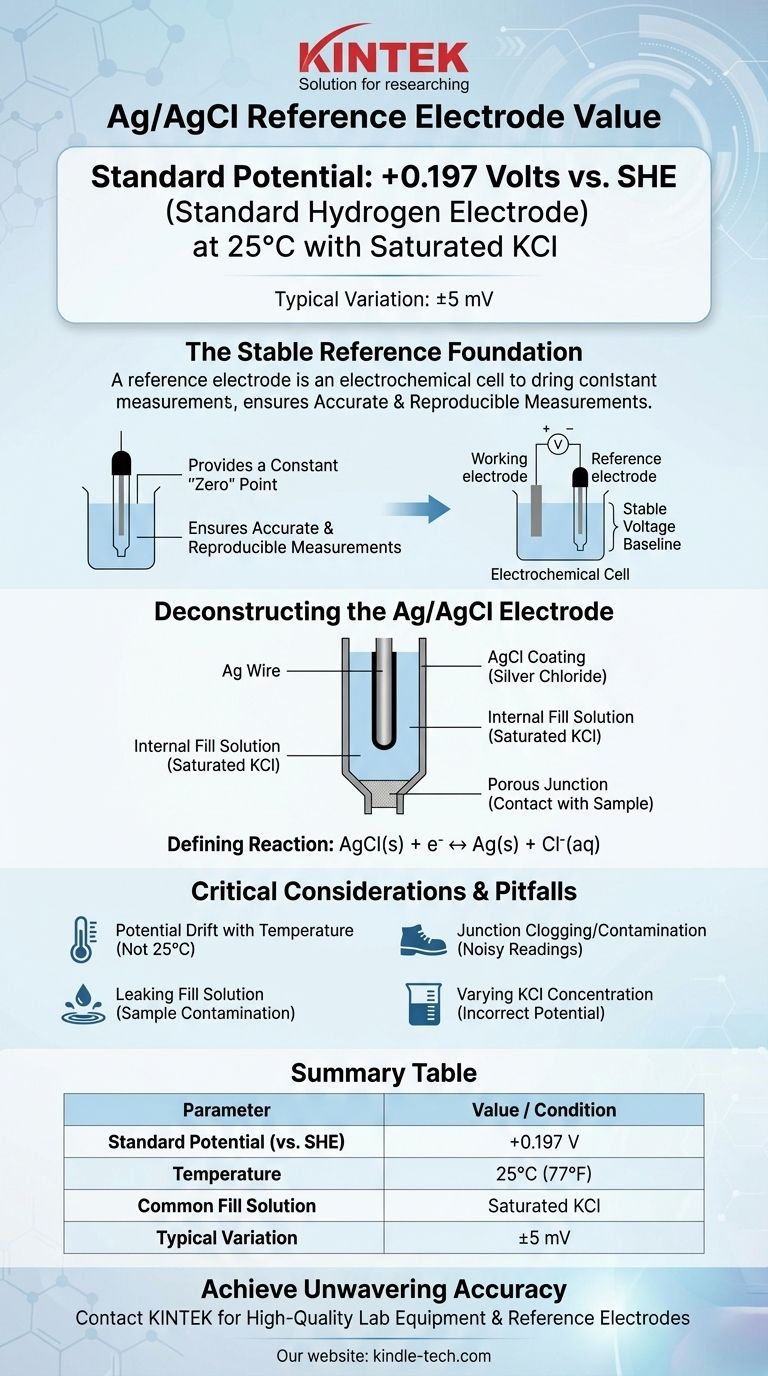
En su configuración más común, el electrodo de referencia de plata/cloruro de plata (Ag/AgCl) tiene un potencial de +0.197 voltios en relación con el Electrodo de Hidrógeno Estándar (SHE) a 25°C. Este valor asume que el electrodo utiliza una solución de llenado de cloruro de potasio (KCl) saturada. Variaciones menores, a menudo citadas como +199 mV (±5mV), son comunes debido a ligeras diferencias en la preparación y las condiciones.
La función principal de un electrodo de referencia es proporcionar una línea base de voltaje inquebrantable y estable. Comprender que el potencial del electrodo de Ag/AgCl se define por un equilibrio químico específico y es sensible a la concentración de cloruro y la temperatura, es clave para usarlo en mediciones precisas y reproducibles.

El papel de una referencia estable
Estableciendo un punto cero
Todas las mediciones de voltaje son inherentemente una diferencia de potencial entre dos puntos. En electroquímica, no se puede medir el potencial absoluto de un solo electrodo de trabajo.
Un electrodo de referencia proporciona un potencial constante y conocido que sirve como el punto "cero" estable. Todos los demás potenciales en su celda electroquímica se miden entonces en relación con esta referencia inquebrantable.
Cómo logra la estabilidad
Un electrodo de referencia ideal se describe como "bien equilibrado". Esto significa que su potencial está gobernado por una reacción química rápida y reversible que no se ve significativamente perturbada por la pequeña cantidad de corriente que fluye durante la medición.
Para el electrodo de Ag/AgCl, esta estabilidad proviene del equilibrio entre el cloruro de plata sólido y los iones de plata y cloruro.
Deconstruyendo el electrodo Ag/AgCl
Los componentes principales
Un electrodo Ag/AgCl típico consiste en un alambre de plata (Ag) que ha sido recubierto con una capa de cloruro de plata sólido (AgCl).
Todo este conjunto se sumerge en una solución de llenado interna que contiene una concentración conocida y fija de iones cloruro (Cl⁻), más comúnmente cloruro de potasio (KCl). Una unión porosa, a menudo hecha de cerámica o algodón, permite el contacto eléctrico con la solución de la muestra.
La reacción electroquímica definitoria
El potencial del electrodo se establece mediante una reacción de media celda simple y reversible:
AgCl(s) + e⁻ ↔ Ag(s) + Cl⁻(aq)
El potencial de este equilibrio depende directamente de la actividad (efectivamente, la concentración) de los iones cloruro en la solución de llenado.
Por qué la solución de llenado es crítica
Debido a que el potencial depende de la concentración de cloruro, su valor debe ser fijo y conocido.
El KCl saturado es la opción más común porque es fácil de preparar y mantener. Mientras haya cristales de KCl sólidos presentes, la solución permanece saturada, asegurando una actividad de cloruro constante y, por lo tanto, un potencial estable de +0.197 V.
También se utilizan otras concentraciones, como 3M o 1M de KCl, y darán como resultado diferentes potenciales de referencia.
Comprendiendo las ventajas y desventajas
Deriva potencial con la temperatura
El potencial estándar de +0.197 V solo es válido a 25°C (77°F). El potencial del electrodo cambiará predeciblemente con la temperatura. Para trabajos de alta precisión, esta dependencia de la temperatura debe tenerse en cuenta o controlarse.
Obstrucción y contaminación de la unión
La unión porosa es el punto de falla más común. Si se obstruye con material de la muestra o si el electrolito interno cristaliza dentro de ella, la conexión eléctrica se rompe, lo que lleva a lecturas ruidosas o completamente inestables.
Fuga de la solución de llenado
La solución de llenado interna se filtra lentamente a través de la unión por diseño. Si su muestra es sensible a los iones cloruro o potasio, esta fuga puede causar contaminación o reacciones secundarias indeseables, interfiriendo con su medición. En estos casos, puede ser necesario un electrodo de doble unión con un electrolito externo diferente.
Asumiendo KCl saturado
Nunca asuma que su electrodo Ag/AgCl utiliza una solución de KCl saturada. Siempre verifique la concentración de la solución de llenado, ya que usar el potencial de referencia incorrecto en sus cálculos es una fuente fundamental de error. Un electrodo con 3M de KCl, por ejemplo, tiene un potencial más cercano a +0.210 V vs. SHE.
Tomando la decisión correcta para su objetivo
Para garantizar que sus mediciones sean sólidas, debe tratar su electrodo de referencia como el instrumento crítico que es.
- Si su enfoque principal es el análisis de rutina (por ejemplo, medición de pH): Utilice un electrodo comercial sellado, guárdelo correctamente en su solución de almacenamiento designada para mantener la unión húmeda y reemplácelo cuando las lecturas se vuelvan inestables.
- Si su enfoque principal es la investigación de alta precisión (por ejemplo, estudios de corrosión): Siempre informe el electrodo de referencia específico utilizado (por ejemplo, Ag/AgCl, KCl sat.) junto con sus datos, controle la deriva y considere calibrarlo con un estándar recién preparado.
- Si su enfoque principal es evitar la contaminación de la muestra: Seleccione un electrodo de doble unión o uno con una solución de llenado que sea químicamente compatible con su muestra para evitar la precipitación o la interferencia en la unión líquida.
Un electrodo de referencia fiable es la base de cualquier medición electroquímica precisa.
Tabla resumen:
| Parámetro | Valor / Condición |
|---|---|
| Potencial estándar (vs. SHE) | +0.197 V |
| Temperatura | 25°C (77°F) |
| Solución de llenado común | KCl saturado |
| Variación típica | ±5 mV |
Logre una precisión inquebrantable en su laboratorio
Sus mediciones electroquímicas son tan fiables como su electrodo de referencia. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, proporcionando los electrodos de referencia Ag/AgCl precisos y estables que su laboratorio necesita para obtener resultados reproducibles.
Deje que nuestros expertos le ayuden a seleccionar el electrodo de referencia perfecto para su aplicación, ya sea análisis de rutina o investigación de alta precisión.
Contacte con KINTEK hoy mismo para asegurar que sus mediciones se construyan sobre una base sólida.
Guía Visual
Productos relacionados
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo de Referencia de Sulfato de Cobre para Uso en Laboratorio
- Electrodo de Disco de Oro
- Electrodo Auxiliar de Platino para Uso en Laboratorio
- Electrodo de disco giratorio (disco de anillo) RRDE / compatible con PINE, ALS japonés, Metrohm suizo de carbono vítreo platino
La gente también pregunta
- ¿Cuál es la aplicación de RRDE? Desbloquee conocimientos cuantitativos sobre catalizadores y reacciones
- ¿Cuáles son las especificaciones de los electrodos funcionales de platino-titanio? Maximizar el rendimiento electroquímico
- ¿Cuáles son las características de rendimiento de los electrodos de alambre/varilla de platino? Estabilidad Inigualable para su Laboratorio
- ¿Cómo se debe limpiar un electrodo de hilo/varilla de platino antes de usarlo? Una guía para datos electroquímicos fiables
- ¿Cuál es el papel común de un electrodo de disco de platino? Una guía para su uso principal como electrodo de trabajo



















