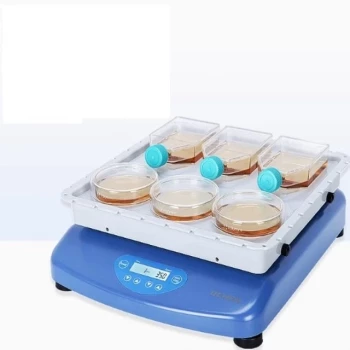
En esencia, el cloruro de potasio (KCl) se utiliza en un electrodo de calomelanos por dos razones fundamentales. Primero, el ion cloruro (Cl⁻) es un componente clave en la reacción química que establece el voltaje estable del electrodo. Segundo, sus iones potasio (K⁺) y cloruro (Cl⁻) se mueven a velocidades casi idénticas en solución, lo cual es la característica definitoria de un electrolito de puente salino ideal.
La doble función del KCl es la clave del éxito del electrodo de calomelanos. No es meramente un componente pasivo; participa activamente en el establecimiento del potencial de referencia al mismo tiempo que previene errores de medición al funcionar como un puente salino altamente efectivo.

El doble papel del KCl en la función del electrodo
La selección de KCl es una elección de ingeniería deliberada diseñada para crear un electrodo de referencia estable, reproducible y conveniente. Sirve para dos propósitos distintos pero igualmente importantes.
Establecimiento del potencial de referencia
El voltaje de un electrodo de calomelanos se genera mediante un equilibrio químico específico: Hg₂Cl₂(s) + 2e⁻ ⇌ 2Hg(l) + 2Cl⁻(aq).
El potencial de esta reacción depende directamente de la concentración de iones cloruro (Cl⁻) en la solución. Al llenar el electrodo con una solución de KCl de concentración conocida y constante, se establece un potencial de referencia estable y predecible.
Lo más común es utilizar una solución saturada de KCl. Esto asegura que la concentración permanezca constante incluso si se evapora algo de agua, proporcionando un voltaje altamente reproducible que lo convierte en un punto de referencia fiable para las mediciones electroquímicas.
Funcionamiento como puente salino ideal
La solución de KCl también actúa como un puente salino, conectando los componentes internos del electrodo de referencia con la solución de muestra que se está midiendo.
Un puente salino eficaz requiere que sus iones positivos y negativos migren a través de la solución a velocidades casi iguales. Esta propiedad se conoce como equitransferencia.
Si un ion se mueve significativamente más rápido que el otro, se acumula una separación de carga en el límite entre las dos soluciones. Esto crea un voltaje no deseado conocido como potencial de unión líquida, que introduce un error significativo en la medición.
Las movilidades de los iones K⁺ y Cl⁻ son casi idénticas, lo que minimiza este potencial de unión y asegura la precisión de la medición.
Ventajas prácticas y compensaciones
El uso de KCl aporta importantes beneficios prácticos, pero también introduce consideraciones que todo analista debe comprender.
Por qué el KCl es conveniente
La naturaleza integrada del KCl —sirviendo tanto a la reacción del electrodo como al puente salino— permite un diseño compacto y robusto.
Un electrodo de calomelanos no requiere un puente salino externo separado. Esto facilita su configuración, uso y transporte en comparación con otros sistemas de referencia. Su potencial también es conocido por ser muy estable con el tiempo.
El impacto de la concentración
El potencial del electrodo de calomelanos depende enteramente de la concentración de KCl. Si bien el KCl saturado es el más común, también se utilizan otras concentraciones como 1 M o 0.1 M para aplicaciones específicas.
El uso de una solución saturada es conveniente porque la concentración se autorregula, pero también significa que el potencial del electrodo es más sensible a los cambios de temperatura, ya que la solubilidad del KCl cambia con la temperatura.
Potencial de contaminación
Una compensación crítica es que la solución de llenado del electrodo puede filtrarse lentamente en la muestra a través de la unión porosa.
Si su análisis involucra iones que precipitan con cloruro, como plata (Ag⁺), plomo (Pb²⁺) o mercurio (Hg₂²⁺), el KCl que se filtra puede causar interferencias y resultados inexactos.
Tomar la decisión correcta para su objetivo
Comprender el papel del KCl le ayuda a determinar cuándo un electrodo de calomelanos es la herramienta adecuada para su medición electroquímica específica.
- Si su enfoque principal es la reproducibilidad y la facilidad de uso: Un Electrodo de Calomelanos Saturado (ECS) es una excelente y clásica elección, siempre que su muestra esté libre de iones interferentes y la temperatura sea estable.
- Si su enfoque principal es minimizar la contaminación por cloruro: Debe usar un sistema de referencia diferente, como un electrodo de mercurio-sulfato mercuroso, que utiliza un electrolito sin cloruro.
- Si su enfoque principal es el rendimiento en diferentes temperaturas: Un electrodo con una solución de KCl no saturada (por ejemplo, 3 M) ofrece un potencial más estable con los cambios de temperatura que una versión saturada.
En última instancia, la elección de KCl es fundamental para el diseño del electrodo de calomelanos, proporcionando la base estable necesaria para mediciones precisas y fiables.
Tabla resumen:
| Función del KCl | Beneficio clave |
|---|---|
| Establece el potencial de referencia | Proporciona un voltaje estable y reproducible a través del equilibrio Hg₂Cl₂/Cl⁻. |
| Actúa como un puente salino ideal | Minimiza el error de medición debido a la movilidad casi igual de los iones K⁺ y Cl⁻. |
| Concentración común | La solución saturada de KCl asegura que la concentración permanezca constante, mejorando la reproducibilidad. |
¿Necesita un electrodo de referencia fiable para el análisis electroquímico de su laboratorio?
En KINTEK, entendemos que la precisión de sus mediciones depende de equipos de laboratorio de alta calidad. Nuestra gama de electrodos y consumibles está diseñada para ofrecer la precisión y fiabilidad que su laboratorio requiere.
Deje que nuestros expertos le ayuden a seleccionar el equipo perfecto para su aplicación específica. ¡Contacte con KINTEK hoy mismo para discutir sus necesidades y asegurar el éxito de su laboratorio!
Guía Visual
Productos relacionados
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo Electroquímico de Disco Metálico
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
- Electrodo de Disco de Oro
La gente también pregunta
- ¿Qué electrodo se utiliza como referencia? Una guía para mediciones electroquímicas precisas
- ¿Cuáles son las precauciones generales para usar un electrodo de referencia? Asegure potenciales estables para datos precisos
- ¿Por qué se utiliza el electrodo de calomelanos como electrodo de referencia secundario? Una guía práctica para mediciones estables
- ¿Qué tipo de electrodo se puede utilizar como punto de referencia? Seleccione el adecuado para mediciones precisas
- ¿Cuáles son los cuatro tipos principales de sensores? Una guía sobre la fuente de alimentación y el tipo de señal