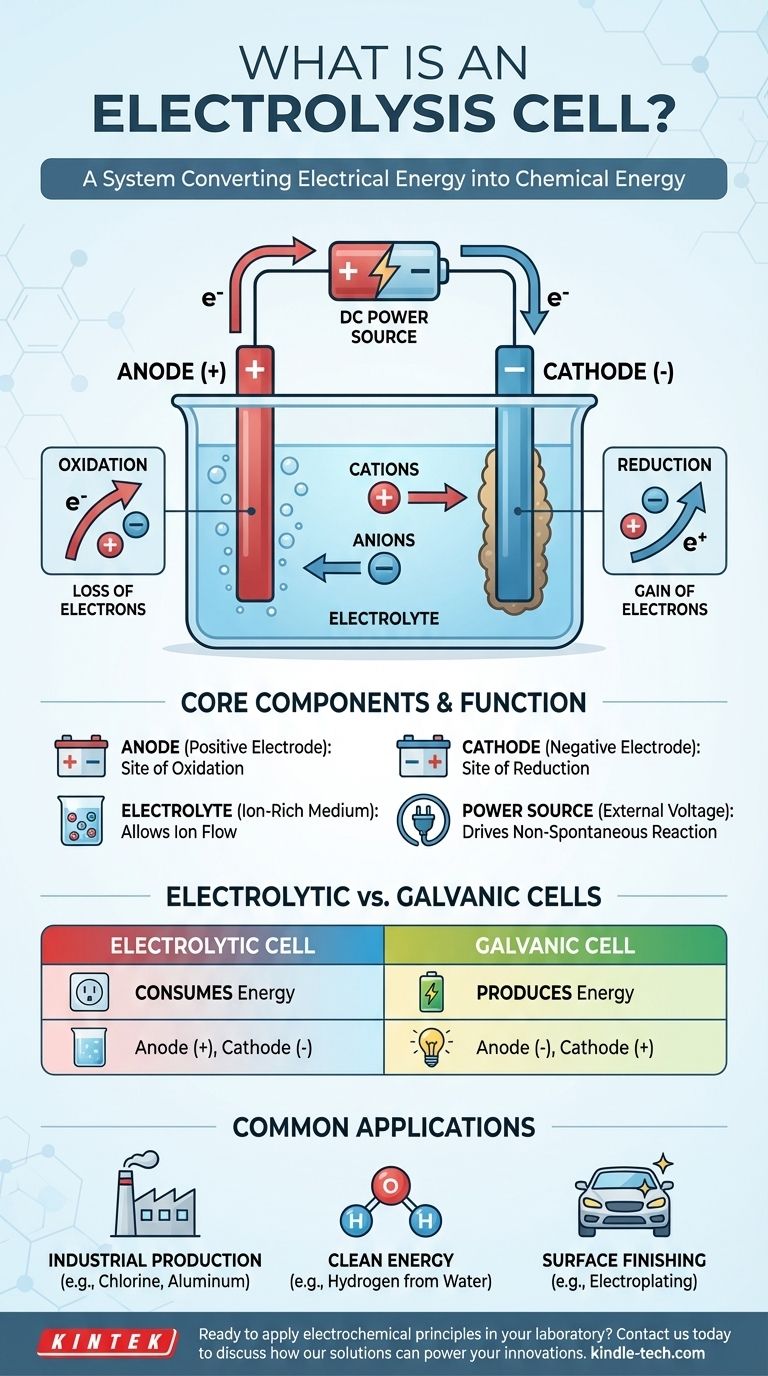
Fundamentalmente, una celda electrolítica es un dispositivo que utiliza energía eléctrica para impulsar una reacción química que de otro modo no ocurriría por sí sola. Efectivamente, revierte el proceso de una batería, consumiendo energía para descomponer compuestos o sintetizar otros nuevos. Esto se logra pasando una corriente eléctrica directa a través de una sustancia llamada electrolito, forzando cambios químicos en dos electrodos.
Una celda electrolítica se entiende mejor como un sistema para convertir energía eléctrica en energía química. Funciona aplicando un voltaje externo para superar el estado natural de un sistema químico, forzando a los iones a reaccionar y crear nuevas sustancias.

Cómo funciona una celda electrolítica
Para comprender el concepto, es esencial comprender los tres componentes principales y cómo interactúan cuando se introduce la electricidad. El proceso es un flujo de carga controlado y dirigido que da como resultado una transformación química.
Los tres componentes esenciales
Una celda electrolítica consta de tres partes principales:
- Un ánodo: El electrodo que está conectado al terminal positivo de la fuente de alimentación.
- Un cátodo: El electrodo que está conectado al terminal negativo de la fuente de alimentación.
- Un electrolito: Una sustancia que contiene iones en movimiento libre, como una sal fundida o un compuesto iónico disuelto en un disolvente como el agua.
El papel del voltaje externo
A diferencia de una batería (una celda galvánica) que produce voltaje espontáneamente, una celda electrolítica requiere una fuente de alimentación externa. Este voltaje aplicado establece un potente campo eléctrico y dicta la polaridad de los electrodos, haciendo que el ánodo sea positivo y el cátodo negativo.
El flujo de iones y electrones
El voltaje aplicado obliga a los iones dentro del electrolito a migrar. Los iones cargados positivamente (cationes) son atraídos hacia el cátodo negativo, mientras que los iones cargados negativamente (aniones) son atraídos hacia el ánodo positivo. Esta migración prepara el escenario para las reacciones químicas.
Oxidación y reducción: la química central
El cambio químico real ocurre en la superficie de los electrodos. Estas reacciones se conocen como reacciones "redox", abreviatura de reducción y oxidación.
El ánodo: sitio de oxidación
El ánodo se define como el sitio de oxidación. Aquí, los aniones que han migrado al electrodo positivo ceden sus electrones sobrantes. Esta pérdida de electrones es la definición de oxidación.
El cátodo: sitio de reducción
El cátodo se define como el sitio de reducción. Los cationes atraídos hacia este electrodo negativo aceptan electrones del circuito. Esta ganancia de electrones es la definición de reducción, lo que a menudo resulta en la deposición de un elemento neutro (como un metal) sobre el cátodo.
Comprender la distinción clave: celdas electrolíticas frente a celdas galvánicas
Un punto común de confusión es la diferencia entre una celda electrolítica y una celda galvánica (como una batería común). Comprender sus funciones opuestas es fundamental.
Consumo de energía frente a producción de energía
La diferencia más importante es el flujo de energía. Una celda electrolítica consume energía para impulsar una reacción no espontánea. Una celda galvánica libera energía de una reacción espontánea.
Polaridad del electrodo
Esta diferencia en la función conduce a una convención de signos opuesta para los electrodos.
- En una celda electrolítica, el ánodo es positivo y el cátodo es negativo.
- En una celda galvánica, el ánodo es negativo y el cátodo es positivo.
Recuerde que en ambos tipos de celdas, la oxidación siempre ocurre en el ánodo y la reducción siempre ocurre en el cátodo. Lo que cambia es la polaridad.
Aplicaciones comunes de la electrólisis
La capacidad de forzar el cambio químico con electricidad hace que las celdas electrolíticas sean increíblemente útiles en muchas industrias.
Producción industrial
La electrólisis es la piedra angular de la industria cloro-álcali, que produce gas cloro e hidróxido de sodio. También es esencial para producir metales puros como el aluminio y el cobre a partir de sus minerales.
Energía limpia
Una de las aplicaciones más prometedoras es la electrólisis del agua. Al pasar una corriente a través del agua, esta puede dividirse en sus elementos constituyentes: hidrógeno y oxígeno. El hidrógeno resultante puede utilizarse como combustible limpio.
Acabado de superficies
La galvanoplastia (electrochapado) es un proceso común en el que se utiliza una celda electrolítica para depositar una fina capa de un metal (como oro o cromo) sobre la superficie de otro objeto, que actúa como cátodo.
Tomar la decisión correcta para su objetivo
Comprender el principio de la electrólisis le permite aplicarlo a objetivos específicos.
- Si su enfoque principal es la producción de material (p. ej., hidrógeno): Reconozca que la celda es una herramienta para descomponer compuestos estables de baja energía (como el agua) en productos de alta energía y valor (como el gas H₂).
- Si su enfoque principal es el recubrimiento de superficies (galvanoplastia): Entienda que su objeto objetivo debe ser el cátodo, ya que aquí es donde los iones metálicos positivos se reducirán y depositarán como una capa sólida.
- Si su enfoque principal es la electroquímica fundamental: La conclusión más crucial es que una celda electrolítica utiliza energía externa para revertir un proceso químico natural, lo que la convierte en un potente motor para la síntesis.
Al dominar estos principios, puede aprovechar la electrólisis como una herramienta poderosa y precisa para la transformación química.
Tabla de resumen:
| Componente | Función | Característica clave |
|---|---|---|
| Ánodo | Sitio de oxidación (pérdida de electrones) | Conectado al terminal positivo de la fuente de alimentación |
| Cátodo | Sitio de reducción (ganancia de electrones) | Conectado al terminal negativo de la fuente de alimentación |
| Electrolito | Proporciona medio para el flujo de iones | Una sal fundida o solución iónica que contiene iones en movimiento libre |
| Fuente de alimentación | Impulsa la reacción no espontánea | Proporciona el voltaje externo necesario para la electrólisis |
¿Listo para aplicar principios electroquímicos en su laboratorio?
Ya sea que su proyecto involucre síntesis de materiales, galvanoplastia o el desarrollo de soluciones de energía limpia, contar con el equipo adecuado es fundamental. KINTEK se especializa en proporcionar equipos y consumibles de laboratorio de alta calidad para apoyar su investigación y desarrollo electroquímico.
Contáctenos hoy para discutir cómo nuestras soluciones pueden impulsar sus innovaciones y brindarle la precisión y confiabilidad que su laboratorio necesita.
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
La gente también pregunta
- ¿Cómo se debe limpiar la celda electrolítica de baño de agua de cinco puertos para su mantenimiento? Una guía paso a paso para resultados fiables
- ¿De qué material está hecha la celda electrolítica de baño de agua de cinco puertos? Vidrio de borosilicato alto y PTFE explicados
- ¿Cómo se debe mantener el cuerpo de una celda electrolítica para su longevidad? Prolongue la vida útil de su equipo
- ¿Cómo se pueden prevenir las fugas al usar una celda electrolítica de baño de agua de cinco puertos? Asegure una Configuración Electroquímica Confiable y Segura
- ¿Cómo se debe operar la celda electrolítica de baño de agua de cinco puertos durante un experimento? Domine el control preciso para obtener resultados fiables



















