En términos técnicos, una celda de electrólisis es un tipo específico de celda electroquímica. Si bien entra en esta amplia categoría, es fundamental comprender que "celda electroquímica" también describe otro dispositivo, la celda galvánica, que realiza la función exactamente opuesta.
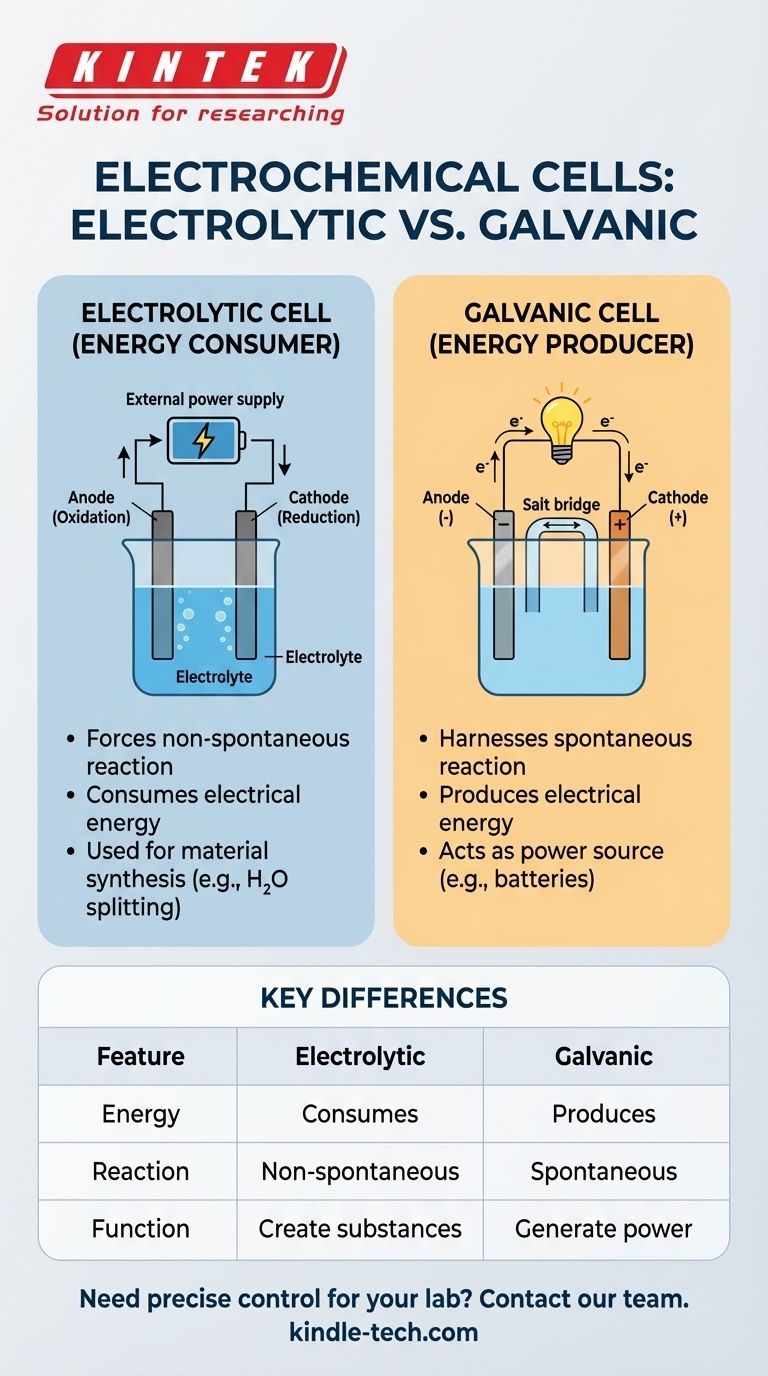
La distinción crucial es la siguiente: Una celda de electrólisis utiliza energía eléctrica externa para forzar una reacción química que no ocurriría por sí sola. Consume energía. En contraste, una celda galvánica (como una batería) utiliza una reacción química espontánea para producir energía eléctrica.

La función principal: forzar una reacción química
¿Qué es la electrólisis?
La electrólisis es el proceso de usar una corriente eléctrica directa (CC) para impulsar una reacción química no espontánea. En términos simples, es usar electricidad para provocar un cambio químico.
El dispositivo donde ocurre este proceso es la celda de electrólisis o celda electrolítica.
El papel de la energía externa
La característica definitoria de una celda electrolítica es su necesidad de una fuente de energía externa, como una batería o una fuente de alimentación. Este voltaje externo supera la barrera de energía natural de la reacción, forzando a los químicos a reaccionar.
Componentes clave
Una celda electrolítica consta de dos electrodos, un ánodo y un cátodo, sumergidos en una solución líquida llamada electrolito. La fuente de energía externa extrae electrones del ánodo (oxidación) y los empuja hacia el cátodo (reducción), impulsando el cambio químico deseado.
Electrolítica vs. Galvánica: El paraguas de la "celda electroquímica"
El término celda electroquímica es una categoría principal para cualquier dispositivo que convierte energía química en eléctrica y viceversa. Comprender los dos tipos principales es esencial para mayor claridad.
Celdas electrolíticas: consumidoras de energía
Estas celdas consumen energía eléctrica para producir un cambio químico. Su propósito principal es crear sustancias o alterar materiales a través de una reacción forzada.
Un ejemplo común es el uso de una celda electrolítica para dividir el agua (H₂O) en hidrógeno y oxígeno gaseoso, un proceso que requiere una entrada de energía significativa.
Celdas galvánicas (voltaicas): productoras de energía
Estas celdas hacen lo contrario. Aprovechan una reacción química espontánea para generar una corriente eléctrica. Este es el principio fundamental detrás de todas las baterías comunes.
Cuando usa una batería, está utilizando una celda galvánica para convertir la energía química almacenada en energía eléctrica utilizable.
Por qué la distinción es importante
Llamar a una celda electrolítica "celda electroquímica" es técnicamente correcto pero impreciso. Es como llamar a un cuadrado "rectángulo". Aunque es cierto, omite las propiedades específicas que lo definen. La diferencia clave siempre es la dirección de la conversión de energía.
Aplicaciones comunes y compensaciones
Dónde se utiliza la electrólisis
La capacidad de forzar reacciones químicas tiene un inmenso valor industrial. Las celdas electrolíticas son esenciales para producir hidrógeno puro para combustible, refinar metales como el aluminio y el cobre a partir de mineral, y electrodepositar objetos con una fina capa de metal como cromo u oro.
La principal compensación: el costo de la energía
La principal limitación de la electrólisis es su alto consumo de energía. Debido a que se está forzando una reacción no espontánea, el proceso siempre requiere más energía que la energía química que se almacena o el valor del producto que se crea. Este costo de energía es la consideración económica y ambiental central para cualquier proceso de electrólisis industrial.
Cómo identificar la celda adecuada para su objetivo
- Si su enfoque principal es almacenar energía o crear materiales (como combustible de hidrógeno o aluminio puro): Está tratando con una celda electrolítica, que consume electricidad para impulsar una reacción química.
- Si su enfoque principal es generar energía a partir de una fuente química (como una batería): Está tratando con una celda galvánica (o voltaica), que produce electricidad a partir de una reacción espontánea.
- Si su enfoque principal es el campo científico general que cubre ambos procesos: Debe usar el término general celda electroquímica.
En última instancia, comprender la dirección del flujo de energía, ya sea que se consuma o se produzca, es la clave para distinguir entre estos dispositivos fundamentales.
Tabla resumen:
| Característica | Celda electrolítica | Celda galvánica |
|---|---|---|
| Conversión de energía | Consume energía eléctrica | Produce energía eléctrica |
| Tipo de reacción | No espontánea (forzada) | Espontánea |
| Función principal | Crear sustancias (ej., H₂, metales refinados) | Generar energía (ej., baterías) |
| Fuente de energía | Requiere fuente externa (ej., batería, fuente de alimentación) | Es la fuente de energía en sí misma |
¿Necesita un control preciso sobre las reacciones químicas en su laboratorio?
Ya sea que su investigación involucre síntesis de materiales, electrodeposición o almacenamiento de energía, contar con el equipo adecuado es fundamental. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluidas celdas electroquímicas y fuentes de alimentación, diseñados para brindar confiabilidad y precisión.
Deje que nuestros expertos le ayuden a seleccionar la configuración perfecta para su aplicación específica. Contacte a nuestro equipo hoy para discutir sus necesidades de laboratorio y descubrir cómo KINTEK puede apoyar sus objetivos de investigación.
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda Electrolítica Electroquímica de Baño de Agua de Doble Capa
- Celdas personalizables de electrólisis PEM para diversas aplicaciones de investigación
- Celda Electrolítica Tipo H Triple Celda Electroquímica
La gente también pregunta
- ¿Cuál es el procedimiento de limpieza para una celda de electrólisis previamente utilizada? Asegure la pureza para obtener resultados fiables
- ¿Cuáles son los pasos para los procedimientos post-experimento después de usar la celda con una solución acuosa convencional? Asegure la precisión y la reproducibilidad
- ¿Cuáles son las precauciones de esterilización y calentamiento para una celda electrolítica de baño de agua de doble capa? Garantice un funcionamiento seguro y resultados precisos
- ¿Cómo influyen las celdas electrolíticas y el control de temperatura en los nanotubos de TiO2? Lograr un control preciso de la morfología
- ¿Cuál es el volumen típico de la celda electrolítica Raman in situ? Explore las opciones estándar de 20 ml y personalizadas.
- ¿Para qué tipo de sistema de electrodos está diseñada la celda electrolítica de evaluación de recubrimientos? Desbloquee el análisis preciso de recubrimientos
- ¿Cuáles son las prácticas recomendadas de mantenimiento y cuidado para la célula electrolítica Raman in-situ? Garantizar la precisión de los datos y la longevidad del equipo
- ¿Cómo contribuye el diseño de una celda electrolítica a simular entornos industriales de hidrógeno? Guía Experta



















