En su esencia, la corrosión es la degradación natural de un metal refinado a una forma químicamente más estable, como su óxido o sulfuro. Dentro de una celda electroquímica, este proceso no es meramente una reacción superficial, sino un circuito completo donde el metal esencialmente se autodestruye al crear una pequeña batería no deseada en su propia superficie.
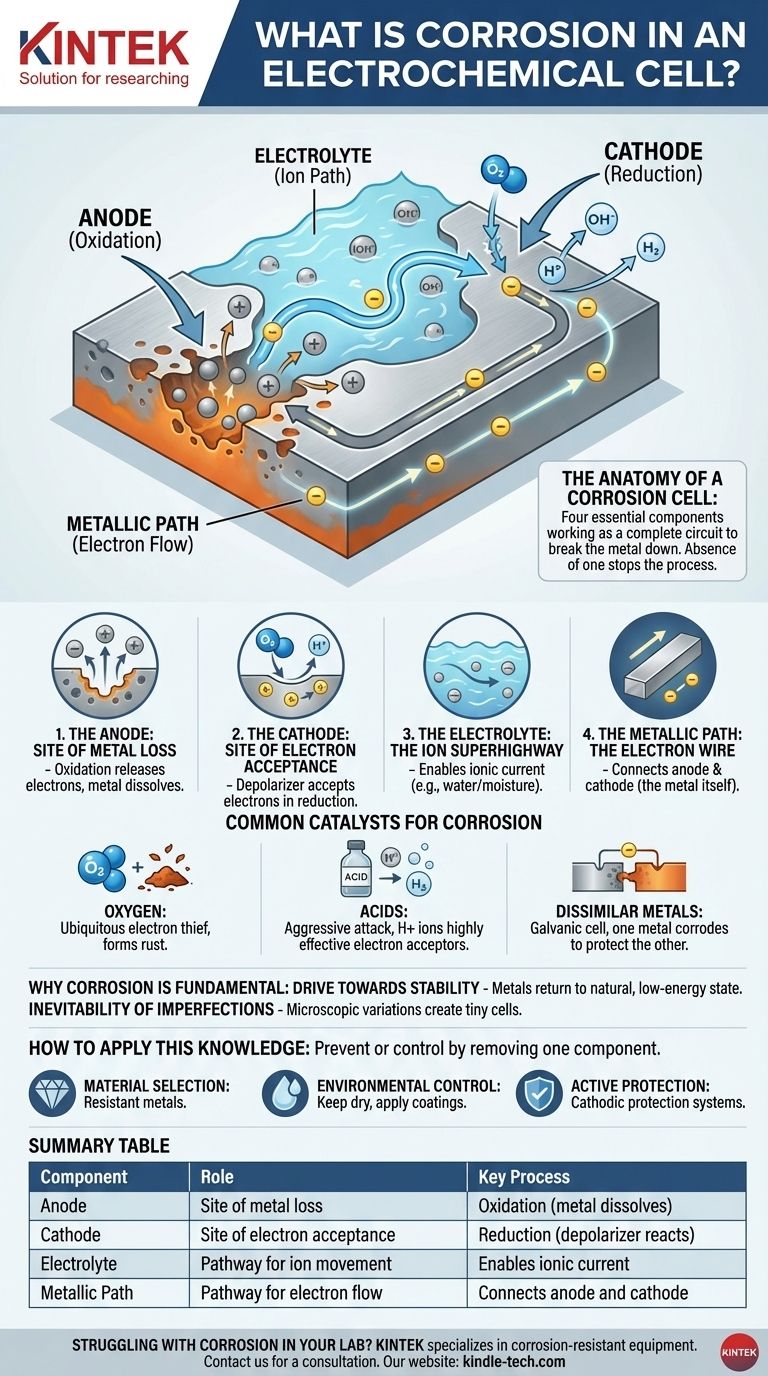
La corrosión es un proceso electroquímico porque involucra los cuatro componentes esenciales de una batería: un ánodo (donde se pierde el metal), un cátodo, un electrolito (como el agua) y un camino metálico, todos trabajando juntos para descomponer el metal.
La anatomía de una celda de corrosión
Comprender la corrosión es comprender los cuatro componentes que requiere para funcionar. La ausencia de cualquiera de estos componentes detendrá el proceso por completo.
El ánodo: El sitio de pérdida de metal
El sitio anódico es el punto específico en la superficie del metal donde ocurre la corrosión. Aquí, los átomos de metal sufren oxidación, perdiendo electrones y transformándose en iones cargados positivamente que se disuelven en el agua o la humedad circundante. Este es el acto físico de que el metal se corroa.
El cátodo: El sitio de aceptación de electrones
Los electrones liberados del ánodo viajan a través del metal a una ubicación diferente, el sitio catódico. Aquí, una sustancia en el ambiente —conocida como despolarizador— acepta estos electrones en una reacción de reducción. Este despolarizador es un ingrediente crítico.
El electrolito: La superautopista de iones
El agua, incluso en cantidades microscópicas como la humedad, actúa como electrolito. Proporciona un medio para que los iones metálicos disueltos (del ánodo) y otros iones viajen, completando el circuito eléctrico. Sin un electrolito, los iones no tienen forma de moverse y el circuito se rompe.
El camino metálico: El cable de electrones
El cuerpo del metal mismo sirve como camino metálico. Proporciona una vía conductora para que los electrones viajen del ánodo al cátodo. Por eso, los sitios anódicos y catódicos pueden estar uno al lado del otro o muy separados en la misma pieza de metal.
Catalizadores comunes de la corrosión
La velocidad y la gravedad de la corrosión a menudo están dictadas por la disponibilidad y el tipo de despolarizador (el aceptor de electrones) en el cátodo.
Oxígeno: El ladrón de electrones ubicuo
En la mayoría de los entornos comunes, el oxígeno disuelto es el principal aceptor de electrones. Por eso, el agua y el oxígeno juntos son tan destructivos para metales como el hierro, lo que lleva a la formación de óxido (óxido de hierro).
Ácidos: Un ataque agresivo
Los ácidos aceleran drásticamente la corrosión. Los iones de hidrógeno (H+) en una solución ácida son aceptores de electrones altamente efectivos, creando gas hidrógeno en el cátodo. Este proceso suele ser mucho más rápido y agresivo que la corrosión impulsada por el oxígeno.
Metales disímiles: La celda galvánica
Cuando dos metales diferentes están en contacto eléctrico dentro de un electrolito, crean una celda galvánica. El metal menos noble y más activo se convertirá en el ánodo y se corroerá rápidamente, mientras que el metal más noble se convierte en el cátodo y está protegido. Por eso se ven ánodos de zinc de sacrificio en los cascos de los barcos para proteger el acero.
Por qué la corrosión es un proceso fundamental
La corrosión no es un defecto; es un proceso natural y espontáneo impulsado por leyes fundamentales de la termodinámica. Comprender esta inevitabilidad es clave para gestionarla.
El impulso hacia la estabilidad
Los metales refinados como el aluminio y el acero son materiales hechos por el hombre que se mantienen en un estado de alta energía. La corrosión es simplemente el proceso por el cual ese metal vuelve a su estado natural de baja energía, similar al mineral del que fue extraído. El metal está liberando su energía almacenada.
La inevitabilidad de las imperfecciones
Ninguna superficie metálica es perfectamente uniforme. Las variaciones microscópicas en la composición, el estrés de la fabricación o incluso las diferencias en la exposición al oxígeno crean pequeños sitios anódicos y catódicos en toda la superficie. Estas imperfecciones son todo lo que se necesita para iniciar miles de celdas de corrosión microscópicas.
Cómo aplicar este conocimiento
Comprender que la corrosión es una celda electroquímica le brinda un marco claro para prevenirla o controlarla. La estrategia siempre es eliminar uno de los cuatro componentes esenciales.
- Si su enfoque principal es la selección de materiales: Utilice metales que sean naturalmente resistentes a la formación de una celda electroquímica en su entorno de servicio, o evite conectar metales disímiles.
- Si su enfoque principal es el control ambiental: Elimine el electrolito manteniendo el metal seco o aplicando un recubrimiento impermeable (como pintura) para evitar que la humedad llegue a la superficie.
- Si su enfoque principal es la protección activa: Cree intencionalmente una celda electroquímica más potente donde su metal estructural se vea obligado a ser el cátodo. Este es el principio detrás de los ánodos de sacrificio y los sistemas de protección catódica.
Al ver la corrosión como un circuito simple, puede diagnosticar sistemáticamente su causa e interrumpir eficazmente su camino destructivo.

Tabla resumen:
| Componente | Función en la celda de corrosión | Proceso clave |
|---|---|---|
| Ánodo | Sitio de pérdida de metal | Oxidación (el metal se disuelve) |
| Cátodo | Sitio de aceptación de electrones | Reducción (el despolarizador reacciona) |
| Electrolito | Vía para el movimiento de iones | Permite la corriente iónica (ej., agua) |
| Camino metálico | Vía para el flujo de electrones | Conecta el ánodo y el cátodo (el metal mismo) |
¿Tiene problemas con la corrosión en su equipo de laboratorio?
La corrosión puede comprometer sus experimentos, dañar instrumentación sensible y provocar costosos tiempos de inactividad. KINTEK se especializa en equipos y consumibles de laboratorio resistentes a la corrosión, ayudándole a proteger sus inversiones y garantizar la integridad de su investigación.
Nuestros expertos pueden ayudarle a seleccionar los materiales y soluciones adecuados para interrumpir el circuito de corrosión en su entorno de laboratorio específico.
Contacte a KINTEK hoy mismo para una consulta y descubra cómo podemos ayudarle a combatir la corrosión y mejorar el rendimiento de su laboratorio.
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica para corrosión plana
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Célula electroquímica de electrólisis espectral de capa fina
La gente también pregunta
- ¿Cómo se utiliza una celda electrolítica de alta precisión para evaluar la resistencia a la corrosión de los metales? Valide los resultados de DCT con precisión
- ¿Cómo garantiza el sistema de celda electroquímica la precisión de la medición durante las pruebas de reactivación potenciocinética electroquímica de doble bucle (DL-EPR) del acero inoxidable dúplex super?
- ¿Cuál es la diferencia entre una celda de corrosión electrolítica y una celda de corrosión electroquímica? Entendiendo la fuerza impulsora detrás de la corrosión
- ¿Qué papel juega una celda electrolítica encamisada por agua en las mediciones de corrosión electroquímica a temperatura variable?
- ¿Cómo funciona una celda electrolítica de tres electrodos? Pruebas de precisión para acero 8620 en entornos corrosivos



















