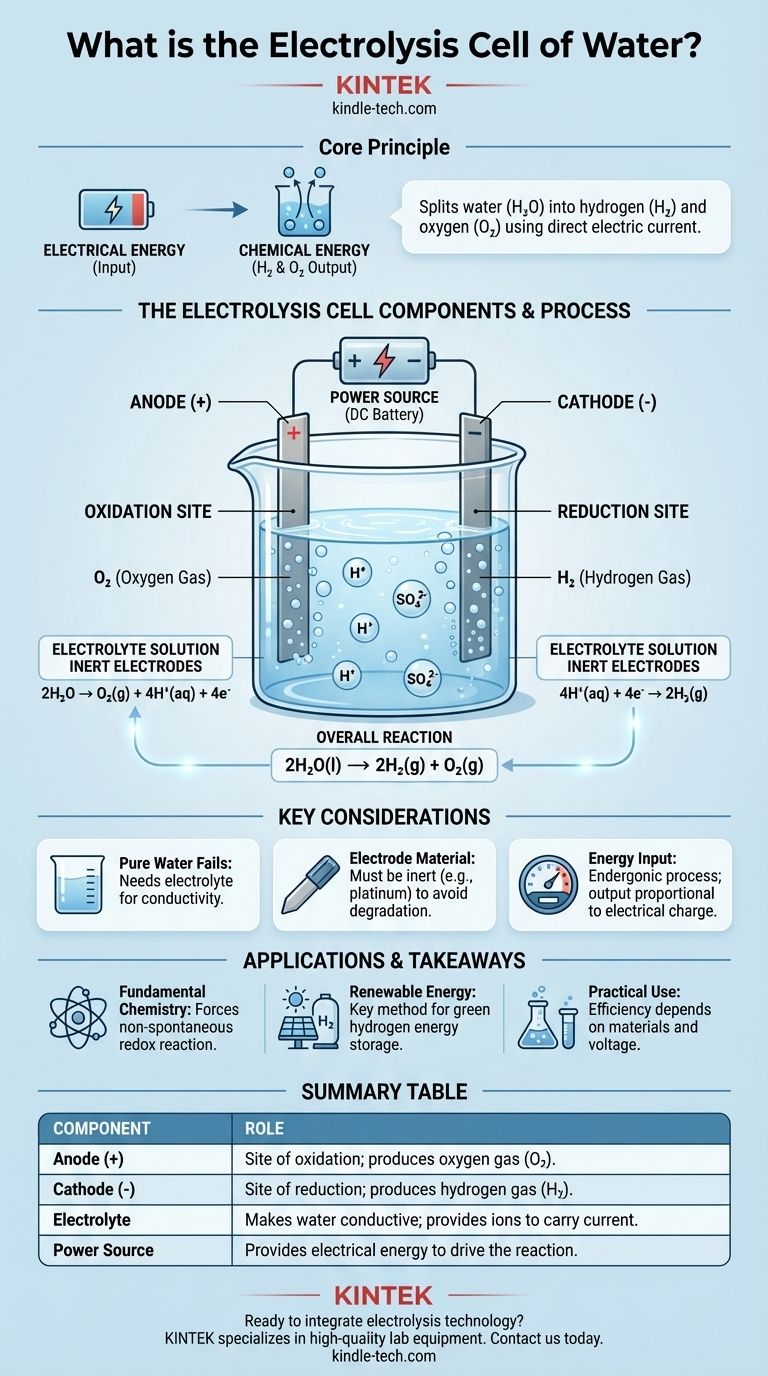
En esencia, una celda de electrólisis del agua es un dispositivo que utiliza energía eléctrica para dividir el agua (H₂O) en sus elementos constituyentes: gas hidrógeno (H₂) y gas oxígeno (O₂). Esto se logra haciendo pasar una corriente eléctrica directa a través de agua que contiene una pequeña cantidad de un electrolito, forzando un cambio químico que no ocurriría por sí solo. Los componentes fundamentales son dos electrodos (un ánodo y un cátodo) sumergidos en el electrolito y conectados a una fuente de energía externa.
El propósito central de una celda de electrólisis es convertir la energía eléctrica en energía química. Utiliza un voltaje externo para impulsar una reacción redox no espontánea, almacenando eficazmente la energía de entrada en los enlaces químicos de las moléculas de hidrógeno y oxígeno resultantes.

Los Componentes Centrales y sus Roles
Una celda electrolítica para agua opera a través de la interacción precisa de tres partes clave: los electrodos, el electrolito y la fuente de energía. Cada uno desempeña un papel distinto y crítico en el proceso.
Los Electrodos: Ánodo y Cátodo
La celda contiene dos electrodos, que son conductores a través de los cuales la electricidad entra y sale de la solución. Estos suelen estar hechos de un material inerte, como platino o grafito, para asegurar que faciliten la reacción sin ser consumidos por ella.
El ánodo es el electrodo positivo. Este es el sitio de oxidación, donde las sustancias pierden electrones.
El cátodo es el electrodo negativo. Este es el sitio de reducción, donde las sustancias ganan electrones.
El Electrolito: Haciendo el Agua Conductora
El agua pura es un conductor muy pobre de electricidad porque contiene muy pocos iones de libre movimiento para transportar una corriente de manera efectiva.
Para resolver esto, se añade una pequeña cantidad de un electrolito, como ácido sulfúrico (H₂SO₄). El electrolito se disuelve en el agua y proporciona iones móviles (en este caso, H⁺ y SO₄²⁻) que pueden transportar carga entre los electrodos, completando el circuito eléctrico.
La Fuente de Energía: Impulsando la Reacción
La división del agua es una reacción endergónica, lo que significa que requiere un aporte de energía para que ocurra. El agua es estable y no se descompondrá espontáneamente.
Una fuente de energía externa, como una batería o una fuente de CC, proporciona el voltaje necesario. Esta presión eléctrica "empuja" los electrones hacia el cátodo y los "jala" del ánodo, forzando la descomposición química del agua.
El Proceso Químico: Cómo se Divide el Agua
El proceso general es una reacción redox (reducción-oxidación), dividida en dos semirreacciones distintas que ocurren en cada electrodo.
Oxidación en el Ánodo (+)
En el ánodo positivo, las moléculas de agua se oxidan. Ceden sus electrones, que luego fluyen fuera de la celda hacia el circuito externo.
Esta reacción produce gas oxígeno (O₂) e iones de hidrógeno (H⁺). La semirreacción es: 2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
Reducción en el Cátodo (-)
Los iones de hidrógeno (H⁺) generados en el ánodo (y presentes del electrolito ácido) son atraídos al cátodo negativo.
En el cátodo, estos iones ganan electrones que fluyen desde el circuito externo. Esta reacción de reducción produce gas hidrógeno (H₂). La semirreacción es: 4H⁺(aq) + 4e⁻ → 2H₂(g)
La Reacción General
Cuando se combinan las dos semirreacciones, los electrones y los iones de hidrógeno en ambos lados se cancelan, revelando el resultado simple y elegante de la electrólisis del agua.
El cambio químico neto es: 2H₂O(l) → 2H₂(g) + O₂(g). Por cada dos moléculas de agua divididas, se producen dos moléculas de gas hidrógeno y una molécula de gas oxígeno.
Comprendiendo las Consideraciones Clave
Si bien el concepto es sencillo, varios factores son críticos para que la celda funcione correcta y eficientemente. Comprender estas limitaciones revela la verdadera naturaleza del proceso.
Por qué Falla el Agua Pura
Sin un electrolito, la resistencia del agua es extremadamente alta. Aplicar un voltaje resultaría en un flujo de corriente insignificante y, por lo tanto, prácticamente ninguna producción de hidrógeno u oxígeno. El electrolito no se consume; su único trabajo es actuar como portador de carga.
El Material del Electrodo es Crucial
Es esencial utilizar electrodos inertes como el platino. Si se utilizara un metal reactivo como el zinc o el cobre para el ánodo, el propio ánodo se oxidaría y se disolvería en la solución en lugar del agua. Esto produciría productos diferentes e involuntarios y destruiría el electrodo.
La Entrada de Energía Dicta la Salida
La electrólisis no es una fuente de energía libre; es un proceso de conversión de energía. La cantidad de hidrógeno y oxígeno producida es directamente proporcional a la cantidad de carga eléctrica que pasa a través de la celda. Se necesita una cantidad significativa de energía eléctrica para producir una pequeña cantidad de gas hidrógeno.
Tomando la Decisión Correcta para su Objetivo
Comprender la celda de electrólisis es valioso para varias disciplinas. Su conclusión depende de su objetivo subyacente.
- Si su enfoque principal es la química fundamental: Vea esto como una demostración perfecta de cómo la energía eléctrica puede forzar una reacción redox no espontánea, separando un compuesto estable en sus elementos.
- Si su enfoque principal es la energía renovable: Reconozca la electrólisis como un método clave para el almacenamiento de energía, convirtiendo el excedente de electricidad de fuentes como la solar o la eólica en combustible de hidrógeno.
- Si su enfoque principal es la aplicación práctica: Recuerde que la eficiencia, la velocidad y los productos de la electrólisis dependen completamente de los materiales específicos utilizados: el electrolito, el material del electrodo y el voltaje aplicado.
En última instancia, la electrólisis del agua es un proceso poderoso que utiliza electricidad para liberar la energía química almacenada dentro de una molécula simple.
Tabla Resumen:
| Componente | Función en la Celda de Electrólisis |
|---|---|
| Ánodo (Electrodo Positivo) | Sitio de oxidación; produce gas oxígeno (O₂). |
| Cátodo (Electrodo Negativo) | Sitio de reducción; produce gas hidrógeno (H₂). |
| Electrolito | Hace que el agua sea conductora; proporciona iones para transportar la corriente. |
| Fuente de Energía | Proporciona la energía eléctrica para impulsar la reacción no espontánea. |
¿Listo para integrar la tecnología de electrólisis en sus flujos de trabajo de laboratorio? KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad para procesos químicos avanzados. Ya sea que esté desarrollando nuevas soluciones de almacenamiento de energía o realizando investigaciones fundamentales, nuestra experiencia garantiza que tenga el equipo confiable que necesita. Contacte a nuestro equipo hoy para discutir cómo podemos apoyar sus requisitos específicos de laboratorio.
Guía Visual
Productos relacionados
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Célula electrolítica electroquímica de cinco puertos
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
La gente también pregunta
- ¿Cuáles son las funciones principales de una estación de trabajo electroquímica (potenciostato)? Análisis experto de la corrosión de aleaciones de titanio
- ¿Cuáles son las especificaciones de volumen típicas y las opciones de personalización para la celda de electrólisis? Adapte su configuración para obtener resultados precisos
- ¿Por qué el material de la ventana de una celda in-situ debe ser reemplazado por PCTFE para imágenes de neutrones? Lograr una claridad de señal superior
- ¿Cuáles son las ventajas de las celdas electrolíticas de tres electrodos? Análisis de precisión para electrodos LTO/LPSC y Nb2O5/LPSC
- ¿Qué comprobaciones deben realizarse antes de usar la celda electrolítica multifuncional? Una guía de 3 pasos para garantizar la seguridad y la precisión
- ¿Cómo revelar la estructura dendrítica de AISI 430 e Inconel 625? Domina el proceso de ataque químico y electrolítico
- ¿Cuáles son las ventajas de la electrodeposición para los GQD sobre el TiO2? Mejore la adhesión y la precisión en su investigación
- ¿Qué papel juegan las membranas de intercambio iónico en la reducción de CO2 de brecha cero? Domina el Motor del Transporte Selectivo



















