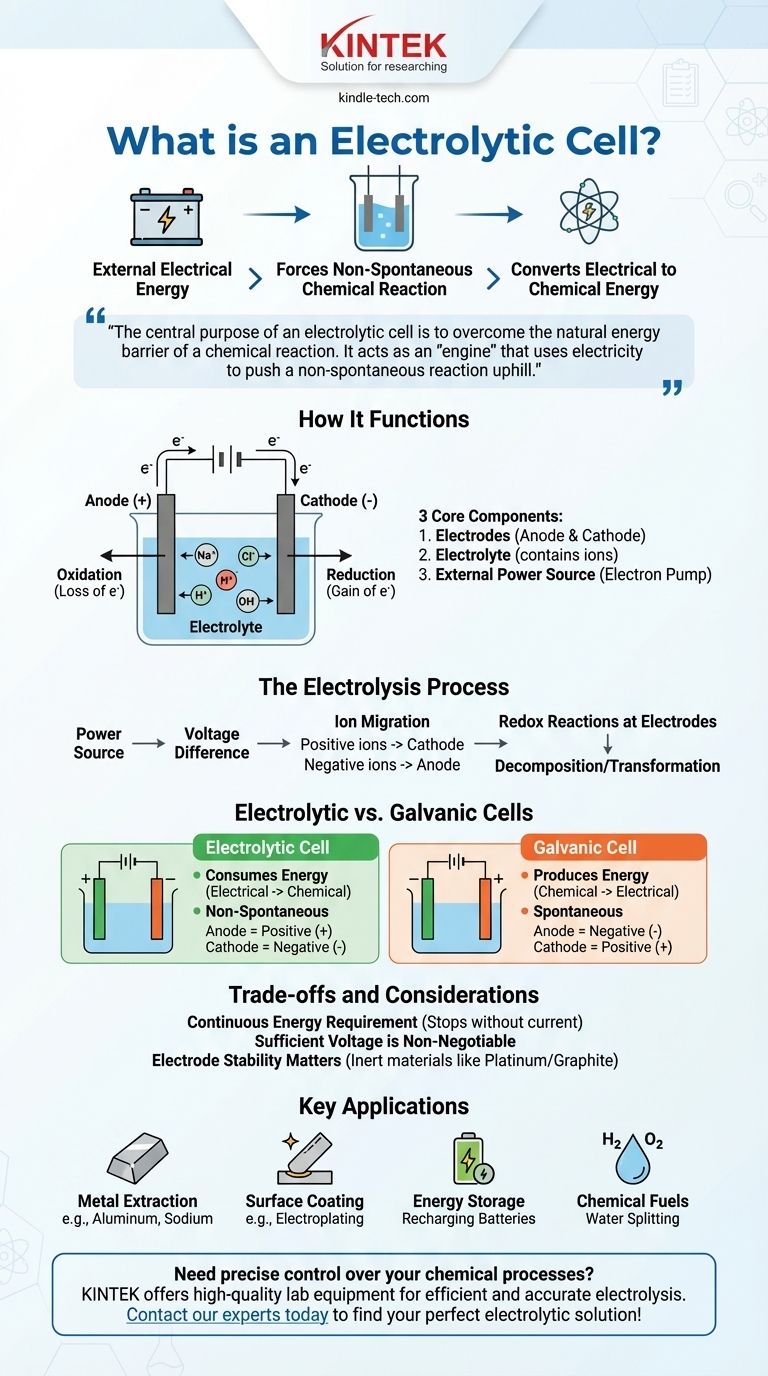
En esencia, una celda electrolítica es un dispositivo que utiliza energía eléctrica de una fuente externa, como una batería, para forzar una reacción química que no ocurriría por sí sola. Este proceso, conocido como electrólisis, convierte la energía eléctrica en energía química almacenada mediante la descomposición de compuestos como el agua o las sales fundidas.
El propósito central de una celda electrolítica es superar la barrera energética natural de una reacción química. Actúa como un "motor" que utiliza la electricidad para impulsar una reacción no espontánea cuesta arriba, logrando tareas como separar elementos o cargar una batería.

Cómo funciona una celda electrolítica
Para comprender una celda electrolítica, debemos observar sus partes esenciales y el proceso que posibilitan. Todo el sistema está diseñado para controlar el flujo de electrones e iones para impulsar un cambio químico específico.
Los tres componentes principales
Una celda electrolítica se construye a partir de tres partes principales.
-
Electrodos (ánodo y cátodo): Son dos conductores metálicos o electrónicos que sirven como sitios para la reacción química. El ánodo es el electrodo positivo donde ocurre la oxidación (pérdida de electrones), y el cátodo es el electrodo negativo donde ocurre la reducción (ganancia de electrones).
-
Electrolito: Es una sustancia, generalmente una solución líquida o una sal fundida, que contiene iones con movilidad libre. El electrolito permite que la carga fluya entre los dos electrodos, completando el circuito eléctrico.
-
Fuente de alimentación externa: Este es un componente crucial, como una batería o una fuente de alimentación de CC. Actúa como una "bomba de electrones", extrayendo electrones del ánodo y empujándolos hacia el cátodo.
El proceso de electrólisis
La fuente de alimentación crea una diferencia de voltaje a través de los electrodos.
Esto obliga a los iones en el electrolito a migrar. Los iones cargados positivamente se mueven hacia el cátodo negativo, y los iones cargados negativamente se mueven hacia el ánodo positivo.
En los electrodos ocurren reacciones redox (transferencia de carga). En el ánodo, las sustancias pierden electrones, y en el cátodo, las sustancias ganan electrones, lo que resulta en la descomposición o transformación de los componentes del electrolito.
La distinción crítica: celdas electrolíticas frente a galvánicas
Un punto común de confusión es la diferencia entre una celda electrolítica y su contraparte, la celda galvánica (o voltaica), que es lo que típicamente consideramos una batería estándar.
Conversión de energía
Una celda electrolítica consume energía. Convierte la energía eléctrica en energía química.
Una celda galvánica produce energía. Convierte la energía química almacenada en energía eléctrica.
Espontaneidad de la reacción
La reacción en una celda electrolítica es no espontánea. Requiere una entrada de energía externa para proceder.
La reacción en una celda galvánica es espontánea. Ocurre naturalmente, liberando energía en el proceso.
Polaridad de los electrodos
En una celda electrolítica, el ánodo es positivo y el cátodo es negativo. Esto se debe a que la fuente de alimentación externa dicta la carga.
En una celda galvánica, el ánodo es negativo y el cátodo es positivo. La reacción química espontánea en sí misma determina la carga.
Comprensión de las compensaciones y consideraciones
Aunque son potentes, las celdas electrolíticas operan bajo restricciones específicas que es importante reconocer.
Un requisito continuo de energía
La característica principal de una celda electrolítica es su dependencia de una fuente de alimentación externa. El proceso de electrólisis se detiene en el momento en que se retira la corriente eléctrica.
Un voltaje suficiente es innegociable
El voltaje externo aplicado debe ser lo suficientemente alto como para superar la resistencia natural de la reacción no espontánea. Si el voltaje es demasiado bajo, no ocurrirá ningún cambio químico.
La estabilidad del electrodo importa
Los electrodos en sí mismos deben elegirse con cuidado. En muchos procesos, están hechos de materiales inertes como platino o grafito que facilitan la reacción sin consumirse. En otras aplicaciones, el material del electrodo se elige intencionalmente para participar en la reacción, como se ve en algunos tipos de purificación.
Aplicaciones clave de las celdas electrolíticas
La capacidad de forzar reacciones químicas otorga a las celdas electrolíticas un papel central en la industria y la tecnología.
- Si su enfoque principal es la producción de elementos puros: La electrólisis se utiliza para extraer metales como el aluminio de su mineral (bauxita) o para producir sodio y gas cloro a partir de cloruro de sodio fundido.
- Si su enfoque principal es el recubrimiento de superficies: El proceso de galvanoplastia utiliza una celda electrolítica para depositar una fina capa de un metal (como cromo u oro) sobre otro para protección o decoración.
- Si su enfoque principal es el almacenamiento de energía: La recarga de una batería implica hacerla funcionar como una celda electrolítica. El cargador externo fuerza a los iones a volver a su estado original, almacenando energía para su uso posterior.
- Si su enfoque principal son los combustibles químicos: Las celdas electrolíticas pueden dividir el agua (H₂O) en gas hidrógeno y gas oxígeno, y el hidrógeno sirve como fuente de combustible limpio.
Al aplicar energía eléctrica con precisión, una celda electrolítica nos da control directo sobre las transformaciones químicas.
Tabla de resumen:
| Característica | Celda electrolítica | Celda galvánica (Batería) |
|---|---|---|
| Conversión de energía | Convierte energía eléctrica en energía química | Convierte energía química en energía eléctrica |
| Tipo de reacción | No espontánea (requiere energía externa) | Espontánea (ocurre naturalmente) |
| Carga del ánodo | Positiva | Negativa |
| Función principal | Impulsar reacciones químicas deseadas (p. ej., galvanoplastia) | Generar electricidad |
¿Necesita un control preciso sobre sus procesos químicos? El equipo de laboratorio de alta calidad de KINTEK, incluidas fuentes de alimentación confiables y electrodos duraderos, es esencial para una electrólisis eficiente y precisa. Ya sea que su aplicación sea la galvanoplastia, la purificación de metales o la investigación de almacenamiento de energía, nuestros consumibles e instrumentos están diseñados para un rendimiento superior. ¡Contacte a nuestros expertos hoy mismo para encontrar la solución electrolítica perfecta para las necesidades de su laboratorio!
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Célula electrolítica de baño de agua de cinco puertos de doble capa
La gente también pregunta
- ¿Por qué son necesarias las cestas de grafito o metal de alta densidad para la reducción de óxidos de actínidos? Funciones clave en la electrólisis directa
- ¿Cuál es la temperatura de funcionamiento recomendada y el sellado para una celda electrolítica de acrílico? Garantizar la seguridad y la integridad del material
- ¿Cuál es el procedimiento para iniciar el experimento y qué se debe observar? Una guía paso a paso para una electroquímica fiable
- ¿Por qué se utiliza una celda electrolítica de cuarzo para aguas residuales de ácido acrílico? Garantizar la estabilidad química y la integridad de los datos
- ¿Cuál es la función principal de un reactor interconectado de tres cámaras? Domine la precisión PEC y la eficiencia de Faraday
- ¿Cómo evalúan las celdas de corrosión de cuarzo y los condensadores de reflujo las aleaciones con alto contenido de Fe y Si? Garantice datos de corrosión precisos
- ¿Por qué son necesarias las celdas electrolíticas de alta precisión para estudiar los inhibidores de la corrosión? Lograr un análisis preciso de la película
- ¿Qué se debe observar durante un experimento con la celda electrolítica tipo H? Monitoreo clave para resultados precisos



















