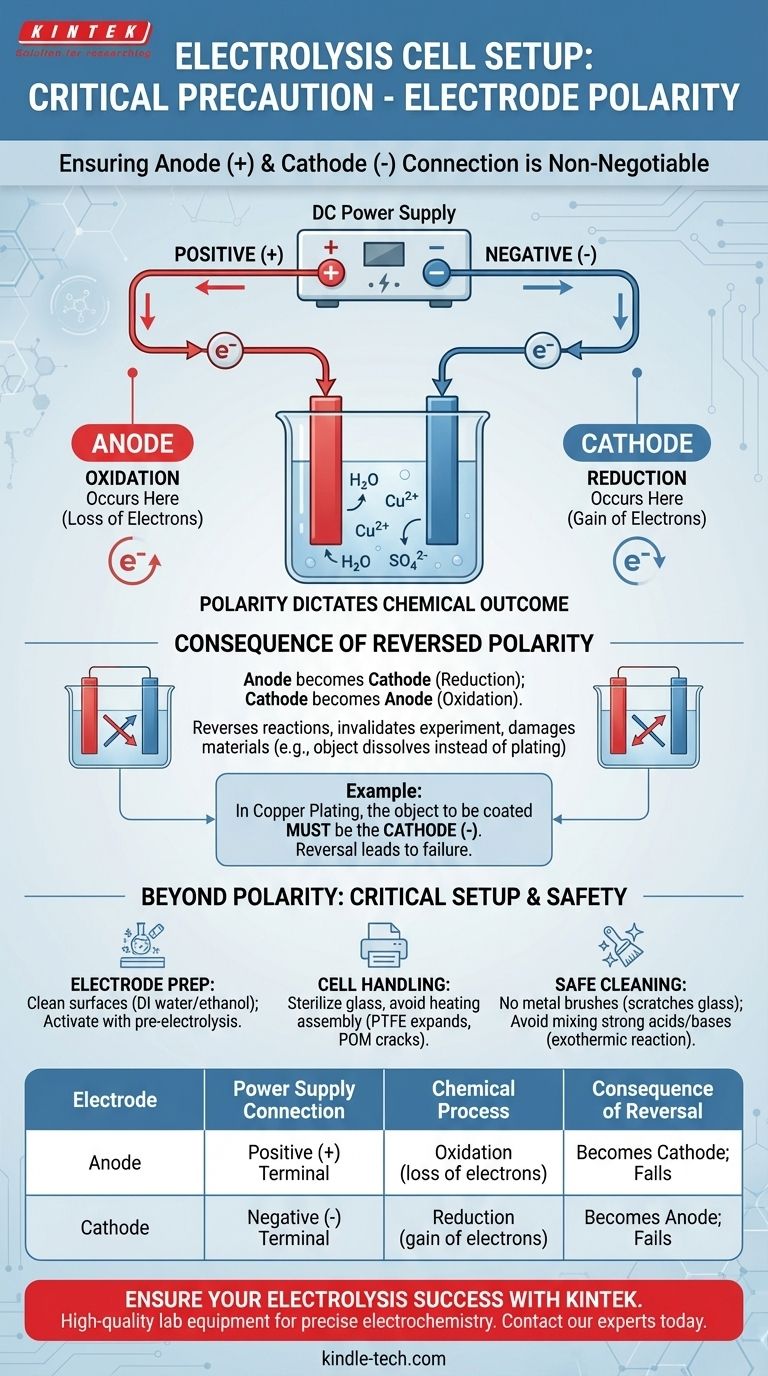
La precaución más crítica con respecto a la polaridad de los electrodos es asegurarse de que el ánodo esté conectado al terminal positivo (+) de su fuente de alimentación de CC y que el cátodo esté conectado al terminal negativo (-). Esta asignación es absoluta y determina el resultado químico completo de su experimento. Invertir esta conexión revertirá las reacciones previstas en cada electrodo, lo que provocará productos incorrectos y posibles daños a sus materiales.
Configurar correctamente la polaridad del electrodo no es solo un paso de procedimiento; es el acto fundamental de definir qué reacción química —oxidación o reducción— ocurrirá en cada superficie. Equivocarse invalida todo el propósito de la electrólisis.

Por qué la polaridad no es negociable en la electrólisis
Una celda electrolítica utiliza energía eléctrica para impulsar una reacción química no espontánea. La polaridad de la fuente de alimentación dicta qué electrodo obliga a una especie química a perder electrones (oxidación) y cuál obliga a una especie a ganarlos (reducción).
El papel del ánodo (oxidación)
El ánodo es, por definición, el electrodo donde ocurre la oxidación. Para forzar a una sustancia a perder sus electrones, debe conectar este electrodo al terminal positivo (+) de la fuente de alimentación de CC. El terminal positivo extrae activamente electrones del ánodo hacia el circuito externo.
El papel del cátodo (reducción)
El cátodo es el electrodo donde ocurre la reducción. Para forzar a una sustancia a ganar electrones, debe conectar este electrodo al terminal negativo (-) de la fuente de alimentación. El terminal negativo empuja activamente electrones desde el circuito externo hacia la superficie del cátodo, donde pueden ser aceptados por el electrolito.
La consecuencia de la polaridad invertida
Si intercambia accidentalmente las conexiones, el electrodo que pretendía que fuera el ánodo se convierte en el cátodo, y viceversa. Las reacciones fundamentales se invierten en cada ubicación.
Por ejemplo, en el recubrimiento de cobre, desea depositar cobre (Cu²⁺ + 2e⁻ → Cu) sobre un objeto. El objeto debe ser el cátodo (terminal negativo). Si lo conecta al terminal positivo, podría comenzar a disolverse en su lugar.
Más allá de la polaridad: precauciones críticas de configuración y seguridad
Un experimento exitoso depende de más que solo la polaridad correcta. El estado físico y químico de su celda y electrodos es igualmente importante para obtener resultados confiables y seguros.
Preparación y activación de los electrodos
Siempre limpie las superficies de sus electrodos antes de un experimento, generalmente con agua desionizada o etanol, para eliminar cualquier impureza orgánica o polvo.
Para algunos materiales, una breve "pre-electrólisis" en el electrolito puede ayudar a activar la superficie eliminando cualquier capa de óxido pasiva que pueda interferir con su reacción principal.
Manejo de la celda y límites de los materiales
Los componentes de vidrio de una celda a menudo se pueden esterilizar bajo vapor a alta presión (121 ℃), pero todo el conjunto nunca debe calentarse.
Materiales como el PTFE (Teflón) pueden expandirse permanentemente cuando se calientan, y el POM (poliacetal) puede agrietarse. Es fundamental respetar estos límites térmicos para evitar dañar la celda.
Procedimientos de limpieza seguros
Nunca use cepillos metálicos para limpiar el interior de una celda de vidrio, ya que pueden crear rayones microscópicos que debilitan el vidrio y crean sitios de contaminación.
Evite mezclar ácidos y bases fuertes (como ácido nítrico e hidróxido de sodio) para fines de limpieza. Esto puede provocar una reacción violenta que genera calor (exotérmica) y es extremadamente peligrosa.
Tomar la decisión correcta para su objetivo
Siempre verifique dos veces sus conexiones con respecto a su objetivo experimental. El papel de cada electrodo se define por lo que necesita lograr.
- Si su enfoque principal es la galvanoplastia o la deposición: El objeto que desea recubrir debe ser el cátodo, conectado al terminal negativo (-).
- Si su enfoque principal es generar gases específicos a partir de un electrolito: Recuerde que el hidrógeno (por reducción de H⁺) se produce en el cátodo (-) y el oxígeno (por oxidación de H₂O u OH⁻) se produce en el ánodo (+).
- Si su enfoque principal es la electrosíntesis o purificación: La polaridad determina qué material de partida se oxida en el ánodo (+) y cuál se reduce en el cátodo (-), por lo que debe configurarse de acuerdo con la vía de reacción deseada.
En última instancia, la polaridad correcta garantiza que esté impulsando el cambio químico específico que tiene la intención de estudiar o producir.
Tabla de resumen:
| Electrodo | Conexión a la fuente de alimentación | Proceso químico | Consecuencia de la inversión |
|---|---|---|---|
| Ánodo | Terminal Positivo (+) | Oxidación (pérdida de electrones) | Se convierte en el cátodo; la reacción de oxidación prevista falla |
| Cátodo | Terminal Negativo (-) | Reducción (ganancia de electrones) | Se convierte en el ánodo; la reacción de reducción prevista falla |
Asegure el éxito de sus experimentos de electrólisis cada vez. La polaridad correcta es solo un aspecto de la configuración adecuada del laboratorio. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, proporcionando las herramientas confiables que necesita para una electroquímica, síntesis y análisis precisos. Comuníquese con nuestros expertos hoy para discutir sus requisitos específicos de laboratorio y descubrir cómo nuestras soluciones pueden mejorar la eficiencia y seguridad de su investigación.
Guía Visual
Productos relacionados
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda Electrolítica Electroquímica de Baño de Agua de Doble Capa
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Qué es la deposición electroquímica en nanotecnología? Un método de bajo costo para construir nanoestructuras
- ¿Cuál es la forma correcta de manipular los componentes de vidrio de la celda electrolítica? Garantice experimentos seguros y precisos
- ¿Qué comprobaciones se deben realizar en la celda electrolítica tipo H antes de su uso? Garantice datos electroquímicos precisos
- ¿Cuál es el método adecuado para limpiar la superficie de una celda electrolítica de PTFE puro? Asegure resultados precisos con una superficie impecable
- ¿Cómo se debe limpiar la celda electrolítica tipo H después de su uso? Mantenimiento experto para resultados electroquímicos puros
- ¿Cuál es el papel de un reactor de vidrio en la electrólisis del agua alcalina? Garantizar la seguridad y la precisión visual
- ¿Cuál es la función principal de una fuente de alimentación de CC en un sistema de electrólisis de agua de mar? Optimice su producción de hidrógeno
- ¿Cuál es la función principal de una membrana de intercambio catiónico? Optimizar la eficiencia y la longevidad del ciclo Cu-Cl



















