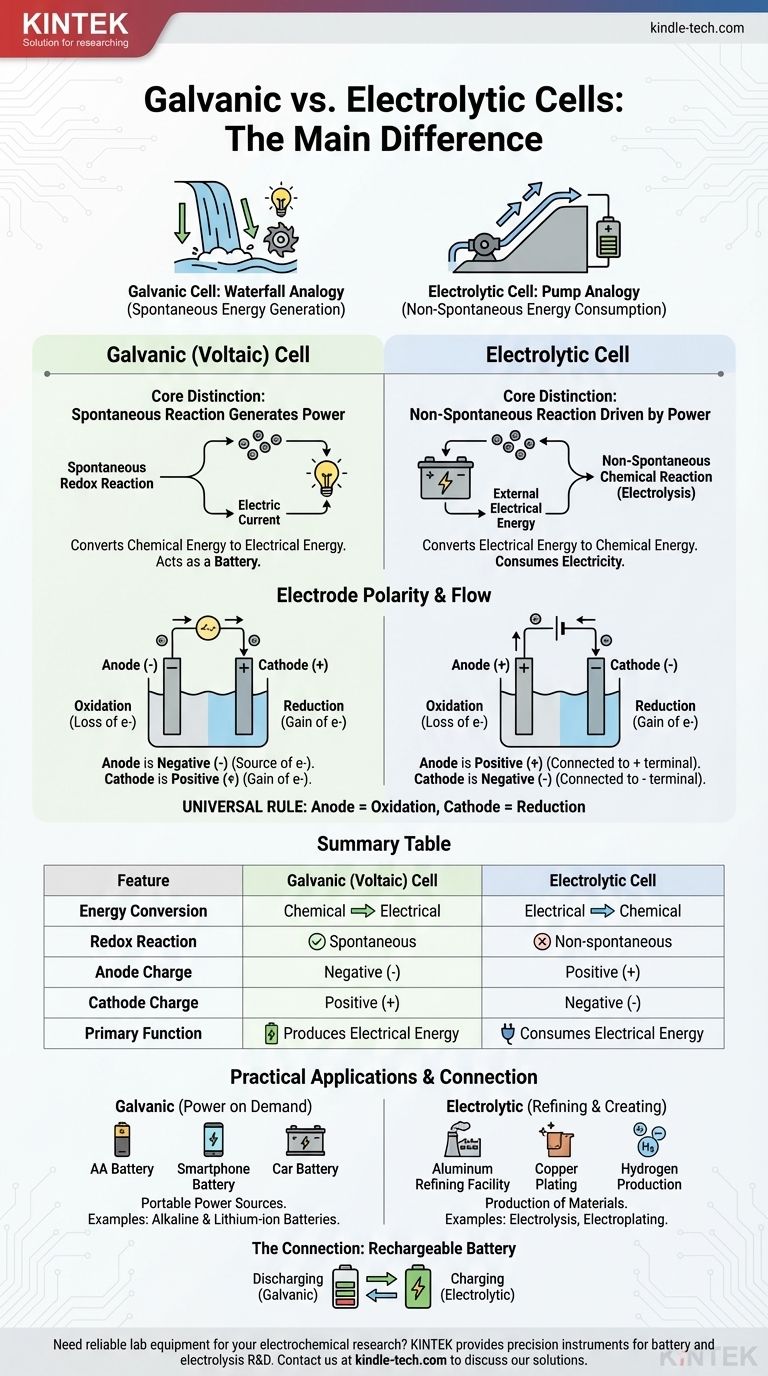
La diferencia fundamental radica en la dirección de la conversión de energía y la naturaleza de la reacción química. Una celda galvánica convierte espontáneamente la energía química almacenada en energía eléctrica, actuando efectivamente como una batería. Por el contrario, una celda electrolítica utiliza una fuente externa de energía eléctrica para forzar que ocurra una reacción química no espontánea.
Piense en ello como la diferencia entre una cascada que genera energía y una bomba que utiliza energía. Una celda galvánica es como una cascada, donde un proceso natural y espontáneo (el agua que fluye cuesta abajo) crea energía. Una celda electrolítica es como una bomba, que utiliza energía externa para forzar un proceso que no ocurriría por sí solo (empujar el agua cuesta arriba).

La distinción central: espontaneidad y flujo de energía
El comportamiento de estas dos celdas se rige por un principio: si la reacción redox interna ocurre por sí sola.
Celdas Galvánicas: Reacciones Espontáneas que Generan Energía
En una celda galvánica, también conocida como celda voltaica, los reactivos químicos elegidos tienen una tendencia natural a reaccionar entre sí.
Esta reacción redox espontánea libera energía. La celda está construida para canalizar esta energía no como calor, sino como un flujo dirigido de electrones, una corriente eléctrica.
Esencialmente, una celda galvánica aprovecha un proceso químico natural para realizar trabajo eléctrico. Este es el principio detrás de todas las baterías.
Celdas Electrolíticas: Reacciones No Espontáneas Impulsadas por Energía
En una celda electrolítica, la reacción química es no espontánea. Los reactivos no interactuarán por sí solos para producir los productos deseados.
Para que la reacción ocurra, se conecta una fuente de alimentación externa (como una batería o una fuente de alimentación) a la celda. Este voltaje externo proporciona la energía necesaria para forzar el movimiento de los electrones e impulsar el cambio químico.
Las celdas electrolíticas consumen electricidad para crear un producto químico, un proceso conocido como electrólisis.
Una mirada más profunda a la polaridad de los electrodos
Si bien los términos "ánodo" y "cátodo" son constantes, su carga (polaridad) es un punto común de confusión porque se invierte entre los dos tipos de celdas. La clave es recordar qué impulsa el flujo de electrones.
El Ánodo: Siempre el Sitio de la Oxidación
En ambos tipos de celdas, el ánodo se define como el electrodo donde ocurre la oxidación (la pérdida de electrones). Esta definición es universal.
El Cátodo: Siempre el Sitio de la Reducción
De manera similar, el cátodo es siempre el electrodo donde tiene lugar la reducción (la ganancia de electrones). Esta es la segunda regla universal.
El Cambio Crítico: Por qué cambia la polaridad
La diferencia en la polaridad surge de si la reacción es espontánea o forzada.
En una celda galvánica, la oxidación espontánea en el ánodo libera electrones, creando una carga negativa. El ánodo es el terminal negativo porque es la fuente de electrones que salen hacia el circuito.
En una celda electrolítica, se utiliza una fuente de alimentación externa. Su terminal positivo atrae electrones del ánodo para forzar la oxidación. Por lo tanto, el ánodo está conectado al lado positivo y se convierte en el terminal positivo.
| Característica | Celda Galvánica (Voltaica) | Celda Electrolítica |
|---|---|---|
| Conversión de Energía | Química a Eléctrica | Eléctrica a Química |
| Reacción Redox | Espontánea | No espontánea |
| Carga del Ánodo | Negativa (-) | Positiva (+) |
| Carga del Cátodo | Positiva (+) | Negativa (-) |
| Función Principal | Produce Energía Eléctrica | Consume Energía Eléctrica |
Comprender las aplicaciones prácticas
Esta diferencia fundamental conduce a usos distintos en tecnología e industria.
Celdas Galvánicas en Acción: Energía a Demanda
Las celdas galvánicas están diseñadas para ser fuentes portátiles de energía eléctrica. Los ejemplos comunes incluyen todos los tipos de baterías, desde las pilas alcalinas AA estándar hasta la batería de iones de litio de su teléfono.
Celdas Electrolíticas en Funcionamiento: Refinación y Creación
Las celdas electrolíticas utilizan energía para producir materiales. Procesos industriales clave dependen de la electrólisis, como la producción de aluminio puro a partir de su mineral, el refinado de cobre y la división del agua para producir gas hidrógeno y oxígeno. La galvanoplastia, donde se deposita una fina capa de metal como plata o cromo sobre otro objeto, es otra aplicación común.
La conexión: cómo funciona una batería recargable
Una batería recargable es la ilustración perfecta de ambos tipos de celdas en un solo dispositivo.
Cuando está alimentando su dispositivo (descargando), está funcionando como una celda galvánica. Una reacción química espontánea dentro de la batería produce una corriente eléctrica.
Cuando la conecta para cargarla, el cargador actúa como una fuente de alimentación externa. Aplica un voltaje que fuerza la reacción inversa no espontánea para que ocurra, reponiendo los reactivos. Durante la carga, la batería funciona como una celda electrolítica.
Tomar la decisión correcta para su objetivo
Su objetivo determina qué marco electroquímico está utilizando.
- Si su enfoque principal es generar electricidad a partir de un proceso químico: Está describiendo una celda galvánica (voltaica).
- Si su enfoque principal es utilizar electricidad para impulsar un cambio químico específico: Está trabajando con una celda electrolítica.
- Si está analizando una batería recargable: Recuerde que funciona como una celda galvánica durante la descarga y como una celda electrolítica durante la recarga.
En última instancia, la espontaneidad de la reacción y la dirección resultante del flujo de energía son las características definitorias que separan estos dos pilares de la electroquímica.
Tabla de resumen:
| Característica | Celda Galvánica (Voltaica) | Celda Electrolítica |
|---|---|---|
| Conversión de Energía | Química a Eléctrica | Eléctrica a Química |
| Reacción Redox | Espontánea | No espontánea |
| Carga del Ánodo | Negativa (-) | Positiva (+) |
| Carga del Cátodo | Positiva (+) | Negativa (-) |
| Función Principal | Produce Energía Eléctrica | Consume Energía Eléctrica |
¿Necesita equipo de laboratorio fiable para su investigación electroquímica? Ya sea que esté desarrollando nuevas tecnologías de baterías u optimizando procesos de electrólisis, KINTEK proporciona los instrumentos de precisión y los consumibles que su laboratorio requiere. Contáctenos hoy para discutir cómo nuestras soluciones pueden impulsar sus innovaciones.
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Célula electrolítica electroquímica de cinco puertos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
La gente también pregunta
- ¿Cómo se debe mantener una celda electrolítica acrílica? Prolongue su vida útil con el cuidado adecuado
- ¿Qué condiciones experimentales proporciona una celda electrolítica de tres electrodos? Optimice el análisis preciso de la corrosión
- ¿Cuál es un ejemplo de electrodeposición? Desde el dorado de joyas hasta la fabricación de microchips
- ¿Cómo se debe operar una celda electrolítica de doble capa con baño de agua? Una guía paso a paso para resultados fiables
- ¿Cuál es la estructura de una celda electrolítica de membrana intercambiable tipo H? Una guía para la separación electroquímica precisa
- ¿Cuáles son los procedimientos operativos generales para una celda espectroelectroquímica de capa delgada durante un experimento? Recopilación de datos sincronizada maestra
- ¿Cómo funcionan los componentes de una celda electroquímica estándar de tres electrodos durante las pruebas de HEA?
- ¿Cómo se definen las funciones del cátodo y el ánodo dentro de una celda electrolítica? Guía experta de electrólisis















