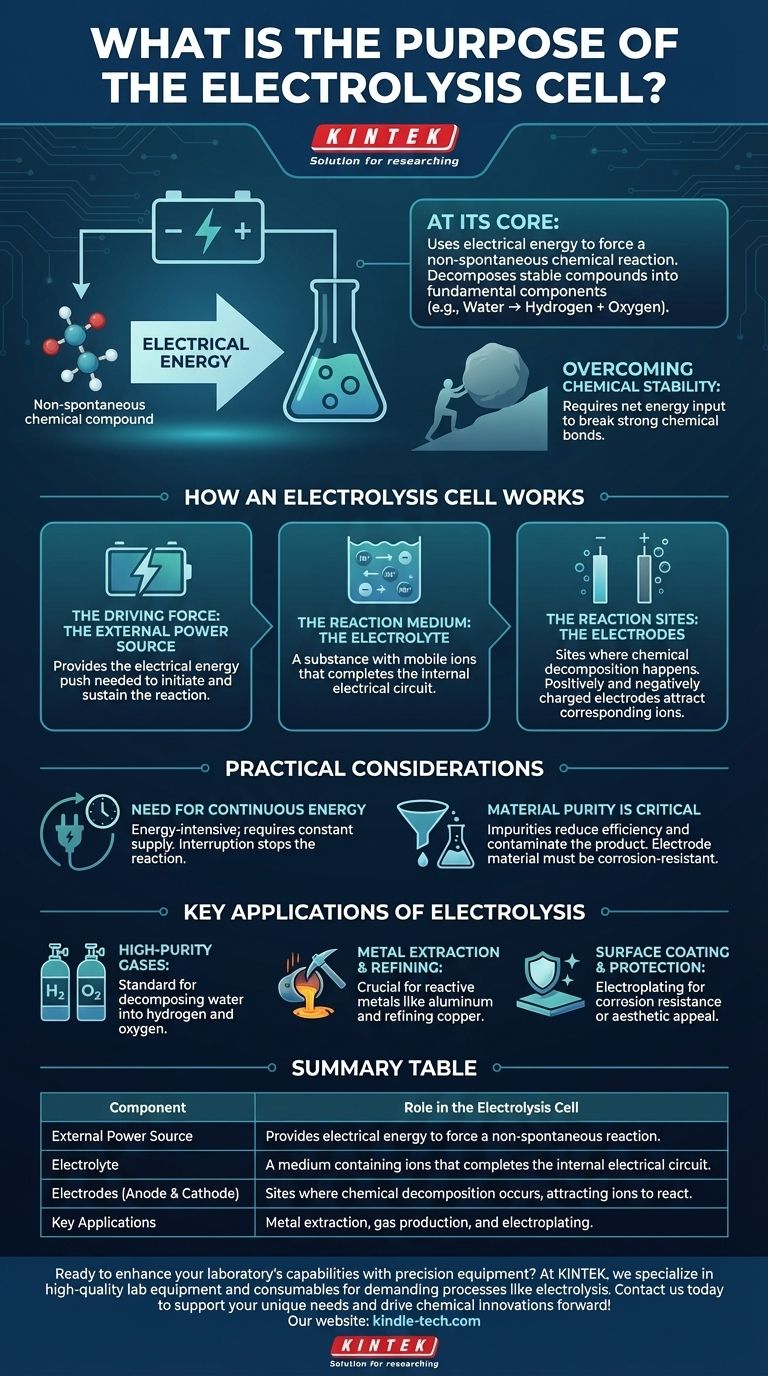
En esencia, el propósito de una celda electrolítica es usar energía eléctrica para forzar una reacción química que no ocurriría por sí sola. Este proceso, conocido como electrólisis, nos permite descomponer compuestos químicos estables en sus componentes más fundamentales, como descomponer el agua en hidrógeno y oxígeno.
Si bien muchas reacciones químicas liberan energía, algunos de los procesos industriales más importantes requieren un aporte de energía para proceder. La celda electrolítica es la herramienta fundamental diseñada para proporcionar esta energía, utilizando electricidad para impulsar reacciones no espontáneas y crear productos químicos valiosos.

Cómo funciona una celda electrolítica
Una celda electrolítica es un sistema con tres componentes críticos que trabajan juntos para lograr un cambio químico específico. Comprender cada parte aclara todo el proceso.
La fuerza impulsora: La fuente de energía externa
Una fuente de energía externa, como una batería, proporciona la energía eléctrica necesaria. Esta energía actúa como el "empuje" necesario para iniciar y mantener una reacción química que no es energéticamente favorable. Sin este voltaje externo, la descomposición no ocurriría.
El medio de reacción: El electrolito
El electrolito es el medio que permite el flujo de partículas cargadas (iones). No es simplemente un líquido; es una sustancia, típicamente una solución de sales disueltas en agua o una sal fundida, que contiene iones móviles. Este movimiento de iones entre los electrodos es lo que completa el circuito eléctrico dentro de la celda.
Los sitios de reacción: Los electrodos
Dos electrodos (un ánodo y un cátodo) están sumergidos en el electrolito. Estos son los sitios físicos donde realmente ocurre la descomposición química. Cuando se aplica la fuente de energía externa, un electrodo se carga positivamente y el otro negativamente, atrayendo los iones correspondientes del electrolito y forzándolos a reaccionar.
El objetivo fundamental: Forzar una reacción no espontánea
El propósito de la celda es superar la estabilidad natural de un compuesto. Esta es la diferencia clave entre una celda electrolítica y una celda galvánica (como una batería estándar), que libera energía de una reacción espontánea.
Superando la estabilidad química
Una reacción no espontánea es aquella que requiere un aporte neto de energía para proceder. Piénsalo como empujar una roca cuesta arriba, no sucederá por sí sola. La energía eléctrica suministrada a la celda electrolítica proporciona la fuerza necesaria para empujar esta "roca química" cuesta arriba, rompiendo fuertes enlaces químicos.
El significado de electrólisis
El nombre mismo explica la función. Proviene de "electro", que se refiere a la electricidad, y la palabra griega "lysis", que significa romper o descomponer. La celda utiliza electricidad para descomponer un compuesto.
Comprendiendo las consideraciones prácticas
Aunque potente, la electrólisis no está exenta de requisitos y limitaciones. Su aplicación es una elección de ingeniería deliberada basada en compromisos específicos.
La necesidad de energía continua
La electrólisis es un proceso que consume mucha energía. Requiere un suministro constante y a menudo sustancial de electricidad para funcionar. Si se interrumpe la energía, la reacción se detiene inmediatamente. Este costo energético es un factor principal en la viabilidad económica de la electrólisis industrial.
La pureza del material es crítica
La pureza del electrolito es crucial. Las impurezas pueden provocar reacciones secundarias no deseadas, reduciendo la eficiencia del proceso principal y contaminando el producto final. La elección del material del electrodo también es vital, ya que debe soportar el ambiente corrosivo y no interferir con la reacción deseada.
Aplicaciones clave de la electrólisis
La aplicación correcta depende completamente de su objetivo final. La versatilidad de la electrólisis la convierte en una piedra angular de la química y la industria modernas.
- Si su enfoque principal es producir gases de alta pureza: La electrólisis es el método estándar para descomponer el agua (H₂O) en hidrógeno y oxígeno excepcionalmente puros.
- Si su enfoque principal es la extracción y refinación de metales: El proceso es indispensable para producir metales altamente reactivos como el aluminio a partir de su mineral (bauxita) o refinar el cobre a una alta pureza.
- Si su enfoque principal es el recubrimiento y la protección de superficies: Un proceso electrolítico similar, conocido como galvanoplastia, se utiliza para depositar una capa delgada de un metal (como cromo u oro) sobre otro para resistencia a la corrosión o atractivo estético.
En última instancia, la celda electrolítica es una herramienta fundamental para convertir la energía eléctrica en un valioso cambio químico, lo que nos permite crear sustancias que la naturaleza no produciría por sí misma.
Tabla resumen:
| Componente | Función en la celda electrolítica |
|---|---|
| Fuente de energía externa | Proporciona energía eléctrica para forzar una reacción no espontánea. |
| Electrolito | Un medio que contiene iones que completa el circuito eléctrico interno. |
| Electrodos (ánodo y cátodo) | Sitios donde ocurre la descomposición química, atrayendo iones para reaccionar. |
| Aplicaciones clave | Extracción de metales (por ejemplo, aluminio), producción de gases (por ejemplo, hidrógeno) y galvanoplastia. |
¿Listo para mejorar las capacidades de su laboratorio con equipos de precisión? En KINTEK, nos especializamos en proporcionar equipos de laboratorio y consumibles de alta calidad adaptados para procesos exigentes como la electrólisis. Ya sea que esté refinando metales, produciendo gases de alta pureza o realizando galvanoplastia, nuestras herramientas confiables garantizan eficiencia y precisión. Contáctenos hoy para descubrir cómo KINTEK puede satisfacer las necesidades únicas de su laboratorio e impulsar sus innovaciones químicas.
Guía Visual
Productos relacionados
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Celda de Flujo Personalizable para Reducción de CO2 para Investigación de NRR, ORR y CO2RR
- Carcasa de batería de litio-aire para aplicaciones de laboratorio de baterías
La gente también pregunta
- ¿Cómo se debe mantener una celda electrolítica de cuarzo y sus componentes para un uso prolongado? Una guía para maximizar la vida útil del equipo
- ¿Cuáles son las aplicaciones principales de la celda electrolítica totalmente de cuarzo? Esencial para análisis ópticos y de alta pureza
- ¿Cuáles son los pasos necesarios para preparar una celda electrolítica totalmente de cuarzo antes de un experimento? Garantice la precisión y la seguridad
- ¿Cuál es el procedimiento adecuado para la limpieza posterior al experimento y el almacenamiento de una celda electrolítica totalmente de cuarzo? Garantizar la longevidad y la reproducibilidad
- ¿Cuáles son los volúmenes y dimensiones disponibles para la celda electrolítica de cuarzo puro? Encuentre el ajuste perfecto para su laboratorio



















