Definición y función de un electrodo
Tabla de contenido
Descripción de un electrodo
Un electrodo es un punto por donde la corriente entra y sale del electrolito. Es un conductor que se utiliza para hacer una unión con una parte no metálica de un circuito. Los electrodos pueden estar hechos de materiales como oro, platino, carbono, grafito o metal. Sirven como superficie para reacciones de oxidación-reducción en celdas electroquímicas. Existen diferentes tipos de electrodos, incluidos ánodos y cátodos.
Papel de un electrodo en una celda electroquímica.
Los electrodos son componentes esenciales de las celdas electroquímicas. Transportan los electrones producidos en la celda de una media celda a otra, creando una carga eléctrica. El cátodo es el electrodo por donde sale la corriente de la celda, mientras que el ánodo es el electrodo por donde entra la corriente. El electrolito de la celda actúa como un conducto para el flujo de electrones entre el cátodo y el ánodo. El potencial de la celda se calcula basándose en un sistema de electrodos estándar con un potencial de referencia de 0 voltios.

Diferencia entre un ánodo y un cátodo
El ánodo y el cátodo desempeñan funciones diferentes en una celda electroquímica. El cátodo está cargado negativamente en las celdas electrolíticas y en este electrodo se produce una reacción de reducción. Los electrones pasan al cátodo durante el funcionamiento de la celda. Por otro lado, en las celdas electrolíticas el ánodo está cargado positivamente y en este electrodo se produce una reacción de oxidación. Los electrones salen del ánodo durante el funcionamiento de la celda. Es importante señalar que las funciones del ánodo y del cátodo pueden cambiar según la dirección del flujo de electrones.
En resumen, los electrodos son conductores utilizados en celdas electroquímicas para facilitar la transferencia de electrones. Desempeñan un papel crucial en el funcionamiento de estas células y se clasifican en ánodos o cátodos según el tipo de reacción química que se produce. Comprender los roles y funciones de los electrodos es esencial en el estudio de la electroquímica.
Mecánica de un electrodo
Proceso de oxidación y reducción en la superficie del electrodo.
Un electrodo es una superficie metálica donde se establece el equilibrio de oxidación-reducción entre el metal y la solución en la que se coloca. El electrodo puede ser un ánodo o un cátodo.
Ánodo: El ánodo recibe corriente o electrones de la mezcla de electrolitos, lo que provoca que se oxide. Cuando los átomos o moléculas se acercan a la superficie del ánodo, la solución dona electrones, lo que da como resultado la formación de iones positivos.
Cátodo: El cátodo, por otro lado, libera electrones en la solución, lo que lleva a la reducción.
Un electrodo debe ser estable y resistir la corrosión, excepto en los casos en que el electrodo sea de sacrificio o se utilice para procesos específicos. La acción mecánica puede provocar la degradación de los electrodos, como la liberación de partículas de grafito, que pueden requerir filtración. La hinchazón del electrodo también puede ser problemática con ciertos materiales.
Papel del ánodo y cátodo en estos procesos.
Los ánodos y cátodos desempeñan funciones cruciales en los sistemas electroquímicos, como baterías, pilas de combustible, células fotovoltaicas, células electrolíticas y diodos.

Ánodo: El ánodo se refiere al electrodo donde se produce la oxidación o por donde salen los electrones. Es el terminal o conductor por donde los electrones salen de la celda electroquímica provocando que se produzca la oxidación. En las celdas primarias, el ánodo es fijo y no se puede recargar, mientras que en las celdas secundarias, el ánodo puede cambiar de polaridad dependiendo de la dirección de la corriente.
Cátodo: El cátodo se refiere al electrodo donde tiene lugar la reducción o donde fluyen los electrones. Los electrones ingresan a la celda por el cátodo y participan en reacciones de reducción. Al igual que el ánodo, el cátodo también puede cambiar de polaridad en las celdas secundarias.
La corrosión en los electrodos puede ser grave, especialmente cuando hay potenciales fluctuantes en el electrolito o cuando se utilizan diferentes metales como ánodo y cátodo. Sin embargo, los inhibidores y otros métodos preventivos pueden ayudar a reducir los ataques a los electrodos.
La electrólisis es un proceso que ocurre en las celdas electrolíticas, donde se utiliza energía eléctrica para realizar reacciones químicas no espontáneas. La oxidación ocurre en el ánodo (placa positiva), mientras que la reducción ocurre en el cátodo (placa negativa).
Comprender la mecánica de un electrodo, incluidos los procesos de oxidación y reducción, así como las funciones del ánodo y el cátodo, es crucial en diversas aplicaciones electroquímicas.
Composición del material de un electrodo
Requisitos para un material de electrodo.
La eficiencia de las celdas electroquímicas está determinada por las propiedades físicas de los electrodos. La composición del material de un electrodo juega un papel crucial en su rendimiento. El principal requisito para el material de un electrodo es la conductividad. Como electrodo se puede utilizar cualquier material conductor, como metales, semiconductores, grafito o polímeros conductores. En muchos casos, los electrodos constan de una combinación de materiales, cada uno con una tarea específica. Estos materiales incluyen:
- Materiales activos: Son las partículas que sufren oxidación o reducción en el electrodo.
- Agentes conductores: Mejoran la conductividad del electrodo.
- Aglutinantes: Se utilizan para contener las partículas activas dentro del electrodo.
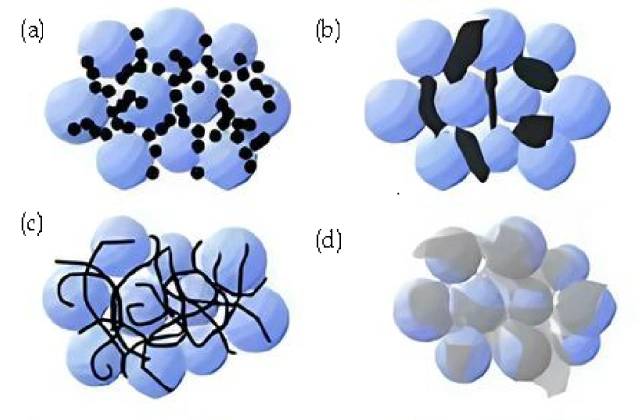
![Resumen de agentes conductores (a. Negro de humo, nanopartículas rígidas; contacto punto a punto. b. Grafito conductor, partículas micrométricas rígidas; contacto punto a punto. c. Nanotubos de carbono, flexibles; contacto lineal y puntual d. Grafito , lámina flexible; superficie y punto de contacto. )]()
Resumen de agentes conductores (a. Negro de humo, nanopartículas rígidas; contacto punto a punto. b. Grafito conductor, partículas micrométricas rígidas; contacto punto a punto. c. Nanotubos de carbono, flexibles; contacto lineal y puntual d. Grafito , lámina flexible; superficie y punto de contacto. )
Además de la conductividad, otras propiedades importantes de los electrodos incluyen la resistividad eléctrica, la capacidad calorífica específica, el potencial del electrodo y la dureza. El coste del material también es un factor importante a considerar para aplicaciones tecnológicas.
Ejemplos de electrodos inertes y reactivos.
Un electrodo puede ser inerte o reactivo, dependiendo de su participación en la reacción de oxidación-reducción (redox). Los electrodos inertes no participan en la reacción y no son químicamente reactivos. Ejemplos de electrodos inertes incluyen grafito (carbono), platino, oro y rodio. Estos materiales se utilizan cuando el único propósito del electrodo es facilitar el flujo de corriente en la celda electroquímica.
Por otra parte, los electrodos reactivos participan activamente en la reacción redox. Sufren oxidación o reducción junto con los reactivos. Por ejemplo, un electrodo de magnesio es un electrodo activo porque participa en la reacción. La elección entre electrodos inertes y reactivos depende de los requisitos específicos del proceso electroquímico.
Papel del electrodo en la reacción.
El electrodo sirve como plataforma para que se produzca la reacción redox. En algunos casos se utilizan como electrodos formas sólidas de los reactivos. Por ejemplo, en una celda electroquímica de cobre y plata, el cobre y la plata son tanto los reactivos como los electrodos. Los electrodos reactivos facilitan la transferencia de electrones e iones durante la reacción redox.
Alternativamente, en reacciones que requieren un electrodo inerte, se utiliza un metal que no participa en la reacción. Un ejemplo de esto es el platino en la reacción del electrodo de hidrógeno estándar (SHE). El electrodo inerte permite el flujo de corriente sin interferir con la reacción química.
La elección del material del electrodo es crucial para lograr rendimientos y selectividad óptimos en procesos electroquímicos. Las propiedades del material influyen en la cinética y termodinámica de la transferencia de electrones y pueden determinar el éxito o el fracaso de una transformación. Consideraciones como el costo, la estabilidad y la manipulabilidad en diversas formas también influyen en la selección del material de electrodo apropiado.
La composición del material y la estructura interna de un electrodo son factores esenciales que determinan su rendimiento. La combinación de materiales activos, agentes conductores y aglutinantes en una suspensión de electrodo mejora su conductividad y funcionalidad. Luego, la mezcla se recubre sobre un conductor, que actúa como colector de corriente en la celda electroquímica.
En resumen, la composición del material de un electrodo, ya sea inerte o reactivo, impacta significativamente su eficiencia y funcionalidad en procesos electroquímicos. La elección del material del electrodo debe basarse en los requisitos específicos de la aplicación, considerando factores como la conductividad, la estabilidad y el costo.
Ejemplos de electrodos
Ejemplos de electrodos inertes y reactivos de uso común.
Se puede distinguir entre electrodos activos y electrodos inertes. Por ejemplo, un electrodo de magnesio suele ser un electrodo activo porque participa en la reacción de oxidación-reducción (redox). Un electrodo de platino suele ser un electrodo inerte porque no participa en la reacción de oxidación-reducción. Un electrodo inerte no es químicamente reactivo y sólo está presente para que la corriente pueda fluir a través de la celda electroquímica.
Ejemplos de electrodos en química analítica
Ejemplos de materiales típicos utilizados para electrodos en química analítica son el carbono amorfo, el oro y el platino. Los electrodos de vidrio se utilizan a menudo en mediciones de pH; En esta aplicación, el vidrio está dopado químicamente para que sea selectivo para los iones de hidrógeno.
Ejemplos de electrodos en baterías
Las baterías contienen una variedad de electrodos, según el tipo de batería.
- Las baterías de plomo-ácido se basan en electrodos de plomo.
- Las baterías de zinc-carbono están fabricadas con electrodos de zinc y carbono amorfo.
- Las baterías de polímero de litio tienen electrodos hechos de una matriz polimérica sólida dentro de la cual los iones de litio pueden moverse y actuar como portadores de carga.
![Baterías de plomo-ácido, baterías de zinc-carbono y baterías de polímero de litio]()
Baterías de plomo-ácido, baterías de zinc-carbono y baterías de polímero de litio
Ejemplos de electrodos en electrólisis
La energía eléctrica se puede utilizar para convertir sales y minerales en metales.
- En el proceso Hall-Heroult para extraer aluminio metálico a partir de óxido de aluminio, el ánodo y el cátodo están hechos de grafito.
- El sodio metálico se produce por electrólisis utilizando un ánodo de carbono y un cátodo de hierro.
Electrodos inertes
Un metal que no interfiere ni participa en ninguna reacción química se conoce como electrodo inerte. Sin embargo, todavía se utiliza para transferir electricidad haciendo pasar electrones a través de la solución en lugar de intercambiar iones.
Ejemplos de electrodos inertes incluyen grafito, platino, oro y rodio.
Electrodos en análisis cuantitativo
En el análisis potenciométrico, un electrodo indicador responde a diferencias en la actividad del analito o "concentración efectiva". Esta simplicidad hace que la potenciometría sea una técnica económica en comparación con la espectroscopia atómica o la cromatografía iónica. Estos procedimientos se pueden clasificar en función de los aspectos de la célula que se controlan.
Usos de los electrodos
Los electrodos se utilizan para proporcionar corriente a través de objetos no metálicos para alterarlos de numerosas maneras y medir la conductividad para diversos fines. Algunos ejemplos incluyen:

- Electrodos para pilas de combustible.
- Electrodos para fines médicos, como EEG (para registrar la actividad cerebral), ECG (registro de los latidos del corazón), ECT (estimulación cerebral eléctrica), desfibrilador (que registra y administra estimulación cardíaca)
- Electrodos para técnicas de electrofisiología en investigación biomédica.
- Electrodos para ejecución en silla eléctrica.
- Electrodos para galvanoplastia.
- Electrodos para soldadura por arco.
- Electrodos para protección catódica.
- Electrodos para puesta a tierra.
- Electrodos para análisis químicos mediante métodos electroquímicos.
- Nanoelectrodos para mediciones de alta precisión en nanoelectroquímica
- Electrodos inertes para electrólisis (hechos de platino)
- Conjunto de electrodo de membrana
- Electrodos para arma de electrochoque Taser.
Electrodo de hidrógeno estándar (SHE)
Definición e importancia de ELLA
Un electrodo de hidrógeno estándar (SHE) es un electrodo que los científicos utilizan como referencia para todas las reacciones potenciales de media celda. El valor del potencial del electrodo estándar es cero, lo que lo convierte en la base para calcular los potenciales de las celdas utilizando diferentes electrodos o concentraciones. Tener un electrodo de referencia común como el SHE es crucial para realizar mediciones y comparaciones precisas en experimentos electroquímicos.
Composición del material y proceso de reacción de SHE.
El SHE está compuesto por una solución 1,0 M H+(aq) que contiene una pieza cuadrada de platino platinizado. El platino está conectado a un alambre de platino, lo que permite el intercambio de electrones. Dentro de un tubo de vidrio, se hace pasar gas hidrógeno a través de la solución, lo que produce la siguiente reacción:
2H+(ac) + 2e- ⇌ H2(g)
Este equilibrio entre los iones de hidrógeno y el gas hidrógeno establece el potencial de referencia del SHE.

Desafíos en la creación y uso de SHE
Configurar y utilizar el SHE puede presentar algunos desafíos. Un desafío es garantizar la estabilidad del electrodo de referencia a lo largo del tiempo y con temperaturas cambiantes. Los componentes del SHE deben ser estables y proporcionar potenciales de electrodo fijos y reproducibles.
Otro desafío radica en la construcción del electrodo de referencia. El SHE consta de una cubierta de vidrio con una pequeña entrada en la parte superior y múltiples salidas en la parte inferior. Dentro de la camisa de vidrio, hay un tubo de vidrio sellado en ambos extremos, que contiene el alambre de platino platinizado y una placa de platino platinizada en el extremo inferior. La camisa de vidrio y el tubo se sumergen en un recipiente que contiene una solución de HCl 1 M. La construcción adecuada de estos componentes es esencial para el correcto funcionamiento del SHE.
En resumen, el electrodo de hidrógeno estándar es una herramienta vital en electroquímica, que sirve como referencia para medir y comparar los potenciales de los electrodos. Su construcción y uso requieren una atención cuidadosa para garantizar la estabilidad y precisión en las mediciones experimentales.
Sistema de tres electrodos
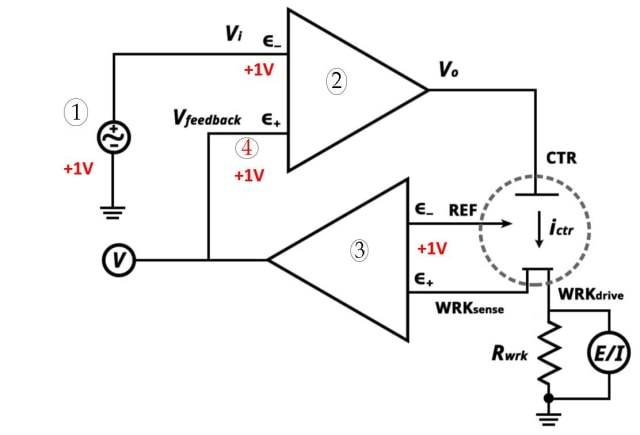
El sistema de tres electrodos es un componente esencial en voltamperometría. Consta de tres electrodos: electrodo de trabajo, electrodo de referencia y electrodo auxiliar. Cada electrodo juega un papel específico en el sistema.
Descripción del sistema de tres electrodos.
El sistema de tres electrodos se utiliza en química electroanalítica para realizar análisis voltamétricos. Permite medir y controlar el flujo de corriente en una celda electroquímica. El sistema consta de los siguientes electrodos:
Electrodo de trabajo : El electrodo de trabajo se encarga de transportar electrones hacia y desde las sustancias presentes en la celda. Facilita las reacciones electroquímicas que ocurren durante la voltamperometría.
Electrodo de referencia : Un electrodo de referencia tiene un potencial de electrodo establecido. Se puede utilizar como media celda en una celda electroquímica. Comparando el potencial del electrodo de trabajo con el electrodo de referencia, se puede determinar el potencial del electrodo de trabajo.
Electrodo auxiliar : El electrodo auxiliar asegura que la corriente no pase a través de la celda de referencia. Equilibra la corriente con la del electrodo de trabajo. El electrodo auxiliar también se conoce como contraelectrodo.
![Sistema de tres electrodos (1. Punto de ajuste potenciostático 2. Amplificador operacional de alta ganancia 3. Electrómetro 4. Muy cerca)]()
Sistema de tres electrodos (1. Punto de ajuste potenciostático 2. Amplificador operacional de alta ganancia 3. Electrómetro 4. Muy cerca)
Funciones de los electrodos de trabajo, de referencia y auxiliares.
En el sistema de tres electrodos, cada electrodo desempeña una función específica:
El electrodo de trabajo facilita las reacciones electroquímicas transportando electrones hacia y desde las sustancias de la celda.
El electrodo de referencia proporciona un potencial de electrodo conocido frente al cual se puede medir el potencial del electrodo de trabajo. Actúa como punto de referencia para determinar el potencial del electrodo de trabajo.
El electrodo auxiliar, también conocido como contraelectrodo, asegura que la corriente fluya a través de la celda electroquímica sin pasar por el electrodo de referencia. Equilibra la corriente con la del electrodo de trabajo.
El sistema de tres electrodos ofrece distintas ventajas sobre las configuraciones de dos electrodos. Permite el aislamiento del electrodo de trabajo, lo que permite el estudio de reacciones específicas con precisión y confianza. Esta configuración se utiliza comúnmente en experimentación electroquímica.
Por otro lado, las configuraciones de dos electrodos se utilizan en casos en los que la medición del voltaje total de la celda es significativa, como en dispositivos de energía electroquímica como baterías, celdas de combustible y supercondensadores. También se puede utilizar cuando se espera que el potencial del contraelectrodo permanezca estable durante todo el experimento.
En general, el sistema de tres electrodos es una herramienta crucial en voltamperometría, ya que permite una medición y control precisos de reacciones electroquímicas.
Ejemplos de electrodos de referencia
Descripción y proceso del electrodo de Calomel.
El electrodo de calomelanos consta de un tubo de vidrio con un brazo. En el fondo del tubo hay mercurio puro con un alambre de platino sellado para las conexiones eléctricas. Por encima del mercurio, hay una pasta de cloruro de mercurio (calomelano) en mercurio. El resto del tubo se llena con una solución saturada de KCl. El brazo se utiliza para sumergirlo en cualquier solución utilizada para acoplar el electrodo de calomelanos.

Funcionamiento: El electrodo de calomelanos puede actuar como electrodo negativo, siendo posibles dos reacciones dependiendo de la naturaleza del otro electrodo al que está acoplado. Al actuar como electrodo negativo, se producen las siguientes reacciones:
- 2 Hg(l) → 2 Hg+ + 2 e–
- 2 Hg+ + 2 Cl– → Hg2Cl2(s)
La reacción de oxidación neta es la formación de cloruro de mercurio.
Ventajas del electrodo de calomelano:
- Relativamente más fácil de fabricar y mantener en comparación con el electrodo de hidrógeno estándar (SHE)
- Compuesto de pasta sólida y mercurio líquido, lo que lo hace cómodo de usar.
- No requiere un puente salino separado porque ya contiene un tubo lateral con solución de KCl
- El potencial no cambia apreciablemente con el tiempo y con ligeros cambios de temperatura.
Desventajas del electrodo de calomelano:
- La compensación del potencial es necesaria al medir potenciales de media celda.
- No se puede utilizar en la medición de potenciales donde interfieren los iones K+ y Cl–.
- El potencial de oxidación depende de la concentración de KCl, por lo que los cambios en la concentración pueden afectar el potencial del electrodo.
Descripción y proceso del electrodo Plata-Cloruro de Plata.
El electrodo de plata-cloruro de plata se utiliza ampliamente como electrodo de referencia debido a su asequibilidad y menor toxicidad en comparación con el electrodo de calomelano. Este electrodo consta de plata sólida y su sal precipitada, AgCl. Se fabrica recubriendo un alambre de plata sólida con AgCl y sumergiéndolo en un tubo de solución de KCl y AgCl.

Funcionamiento: El electrodo de plata-cloruro de plata permite que se formen iones y que los electrones fluyan dentro y fuera del sistema de electrodos. Puede actuar como electrodo de referencia cuando se acopla con otro electrodo.
Ventajas del electrodo de plata-cloruro de plata:
- Barato y ampliamente disponible
- Menos tóxico en comparación con el electrodo Calomel.
- Fácil de configurar y reproducir
- Cómodo y fácil de transportar
- Compacto y de menor tamaño, requiriendo poco espacio
- No se requiere un puente salino separado ya que ya contiene un tubo lateral con solución de KCl
- El potencial se mantiene relativamente estable en el tiempo y con ligeros cambios de temperatura
Los electrodos de referencia son esenciales en el análisis electroquímico ya que proporcionan un potencial estable y constante para las mediciones sensoriales. El electrodo de calomelano y el electrodo de plata-cloruro de plata son dos ejemplos comúnmente utilizados en electroquímica acuosa. Tienen sus ventajas y desventajas y su idoneidad depende de la aplicación y los requisitos específicos.
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
- Celda electrolítica para corrosión plana
- Electrodo de Hoja de Oro Electrodos de Oro para Electroquímica
Artículos relacionados
- El Recipiente de la Verdad: Por qué el Contenedor Importa Más que la Química
- El Corazón de Cristal: Por Qué la Buena Ciencia Muere en Celdas Sucias
- Comprensión de la Corrosión Plana en Celdas Electrolíticas: Aplicaciones, mecanismos y técnicas de prevención
- Medidores manuales de espesor de revestimientos: Medición precisa para galvanoplastia y revestimientos industriales
- La Paradoja de la Transparencia: Dominando el Frágil Arte de las Celdas Electrolíticas