Definición y funciones básicas de la celda electrolítica.
Tabla de contenido
Comprender el papel de la energía eléctrica y la energía química en una celda electrolítica.
Celda electroquímica Una celda electroquímica es un dispositivo capaz de generar energía eléctrica a partir de reacciones químicas o facilitar reacciones químicas mediante la introducción de energía eléctrica.
Definir electroquímica La electroquímica es el estudio de los procesos químicos que hacen que los electrones se muevan. Se trata de la interacción entre la energía eléctrica y el cambio químico.
Ejemplo: El estudio de las celdas electroquímicas viene en electroquímica. Se trata de células que convierten la energía química en energía eléctrica.
Importancia de la electroquímica La electroquímica se ocupa de las relaciones entre los fenómenos eléctricos y químicos. Los procesos electroquímicos se utilizan en diversas ramas de la industria. Es el proceso más importante para la producción de varios productos químicos. La producción de diversos metales se basa en el método electroquímico. El hidrógeno se fabrica mediante la electrólisis del agua. También juega un papel importante en el desarrollo del automóvil eléctrico.
Descripción de los componentes de una celda electrolítica, incluidos electrodos y electrolito.
Las celdas electrolíticas se componen de 3 componentes esenciales.

El Ánodo es el electrodo negativo o reductor que libera electrones al circuito externo y se oxida durante una reacción electroquímica.
El Cátodo es el electrodo positivo u oxidante que adquiere electrones del circuito externo y se reduce durante la reacción electroquímica.
El Electrolito es el medio que proporciona el mecanismo de transporte de iones entre el cátodo y el ánodo de una celda. A menudo se piensa que los electrolitos son líquidos, como agua u otros disolventes, con sales, ácidos o álcalis disueltos que se requieren para la conducción iónica. Sin embargo, cabe señalar que muchas baterías, incluidas las convencionales (AA/AAA/D), contienen electrolitos sólidos que actúan como conductores iónicos a temperatura ambiente.
Consideraciones en la selección de Cátodo, Ánodo y Electrolito
A continuación se indican las propiedades deseables para materiales de ánodos, cátodos y electrolitos.
Explicación del proceso de transferencia de carga entre electrodos e iones.
Celda electrolítica, cualquier dispositivo en el que la energía eléctrica se convierte en energía química, o viceversa. Una celda de este tipo normalmente consta de dos conductores (electrodos) metálicos o electrónicos separados entre sí y en contacto con un electrolito (qv), generalmente un compuesto iónico disuelto o fusionado. La conexión de los electrodos a una fuente de corriente eléctrica directa hace que uno de ellos esté cargado negativamente y el otro positivamente. Los iones positivos del electrolito migran al electrodo negativo (cátodo) y allí se combinan con uno o más electrones, perdiendo parte o la totalidad de su carga y convirtiéndose en nuevos iones de menor carga o átomos o moléculas neutras; al mismo tiempo, los iones negativos migran al electrodo positivo (ánodo) y le transfieren uno o más electrones, convirtiéndose también en nuevos iones o partículas neutras. El efecto general de los dos procesos es la transferencia de electrones de los iones negativos a los iones positivos, una reacción química (ver reacción de oxidación-reducción). Un ejemplo es la electrólisis del cloruro de sodio (sal común), formando sodio metálico y cloro gaseoso; la energía necesaria para que se produzca la reacción es suministrada por la corriente eléctrica. Otras aplicaciones comunes de la electrólisis incluyen la electrodeposición para refinar o enchapar metales y la producción de sosa cáustica.
¿Qué es una celda electrolítica? Una celda electrolítica se puede definir como un dispositivo electroquímico que utiliza energía eléctrica para facilitar una reacción redox no espontánea. Las celdas electrolíticas son celdas electroquímicas que se pueden utilizar para la electrólisis de ciertos compuestos. Por ejemplo, el agua se puede someter a electrólisis (con la ayuda de una celda electrolítica) para formar oxígeno gaseoso e hidrógeno gaseoso. Esto se hace utilizando el flujo de electrones (hacia el entorno de reacción) para superar la barrera de energía de activación de la reacción redox no espontánea.


Los tres componentes principales de las celdas electrolíticas son: Cátodo (que está cargado negativamente en las celdas electrolíticas) Ánodo (que está cargado positivamente en las celdas electrolíticas) Electrolito El electrolito proporciona el medio para el intercambio de electrones entre el cátodo y el ánodo. Los electrolitos comúnmente utilizados en las celdas electrolíticas incluyen agua (que contiene iones disueltos) y cloruro de sodio fundido.
CÉLULAS ELECTROLÍTICAS Para definir las celdas electrolíticas, primero debemos entender la electrólisis. La electrólisis es un método que consiste en hacer pasar una corriente eléctrica a través de un líquido que contiene iones, lo que hace que los compuestos del interior se desintegren. Se utiliza para aislar el metal de elementos metálicos, segregar otras sustancias químicas (como agua) y galvanizar metales y recargar baterías. Un circuito completo es fundamental para mantener un proceso electrolítico; Necesitamos poder extraer electricidad de la celda continuamente.
El cátodo y el ánodo de una celda electrolítica están conectados a una fuente de energía. Estos dos electrodos estables y una solución electrolítica fluida se encuentran en cada celda electrolítica. La solución de electrolito conduce electricidad ya que los iones disueltos pueden moverse libremente en la solución.
Celda electrolítica y sus componentes La celda electrolítica consta de tres componentes principales: batería, electrodos y electrolito. Batería La batería funciona como fuente de energía. Proporciona la energía eléctrica para provocar el cambio químico, es decir, la descomposición del compuesto iónico. Electrodos Los electrodos son contactos eléctricos que cierran o completan el circuito eléctrico entre los cables y el electrolito. Ejemplos de electrodos incluyen varillas de carbono (grafito) y placas de metal. El electrodo de la izquierda (consulte la imagen de arriba) que está conectado al terminal positivo de la batería es el electrodo positivo o ánodo. El electrodo de la derecha que está conectado al terminal negativo de la batería es el electrodo negativo o cátodo. Electrolito El electrolito es una sustancia que contiene iones móviles, cuando están fundidos o en solución acuosa, para conducir la electricidad. Ejemplos de electrolitos incluyen cloruro de sodio fundido, solución de sulfato de cobre (II) y ácidos, como el ácido clorhídrico diluido. Ejemplos de no electrolitos incluyen soluciones de azúcar, etanol y azufre (fundido), ya que son líquidos o soluciones que no contienen iones móviles para conducir electricidad.

Aplicaciones Las celdas electrolíticas se utilizan a menudo para descomponer compuestos químicos, en un proceso llamado electrólisis (electro significa electricidad y la palabra griega lisis significa romper). Ejemplos importantes de electrólisis son la descomposición del agua en hidrógeno y oxígeno, y de la bauxita en aluminio y otras sustancias químicas. La galvanoplastia (por ejemplo, de cobre, plata, níquel o cromo) se realiza utilizando una celda electrolítica. La electrólisis es una técnica que utiliza una corriente eléctrica continua (CC).
Comercialmente, las celdas electrolíticas se utilizan en la electrorefinación y electroobtención de varios metales no ferrosos. La mayoría del aluminio, cobre, zinc y plomo de alta pureza se producen industrialmente en celdas electrolíticas.
Una celda electrolítica Los tres componentes de las celdas electrolíticas son un electrolito y dos electrodos.
Electrolitos Los electrolitos son sustancias que dan una solución eléctricamente conductora cuando se disuelven en solventes polares, como el agua. Esto se debe a que cuando el electrolito se disuelve en disolventes polares, se rompe en cationes y aniones y se distribuye uniformemente por toda la solución. Estos cationes y aniones bajo un potencial eléctrico en la solución se mueven hacia el electrodo con abundancia de electrones y déficit de electrones, respectivamente. Este movimiento de cationes y aniones en direcciones opuestas genera corriente y forma las células electrolíticas.
Si bien las sales, los ácidos y las bases forman un electrolito, pocos gases, bajo ciertas condiciones, también pueden comportarse como un electrolito, como el cloruro de hidrógeno a alta temperatura y baja presión.
Reacciones químicas en celda electrolítica.
Explicación de la reacción de oxidación-reducción en una celda electrolítica.
En las celdas electroquímicas tienen lugar reacciones de oxidación-reducción (redox). Hay dos tipos de celdas electroquímicas: celdas galvánicas (voltaicas), donde ocurren reacciones espontáneas, y celdas electrolíticas, donde ocurren reacciones no espontáneas.
Ambos tipos de celdas tienen electrodos donde ocurren reacciones de oxidación y reducción. La oxidación ocurre en el electrodo llamado ánodo y la reducción ocurre en el electrodo llamado cátodo.
En una celda electrolítica, el ánodo es positivo y el cátodo es negativo. Esto se debe a que el ánodo atrae aniones de la solución. Por otro lado, en una celda galvánica, el ánodo está cargado negativamente, ya que la oxidación espontánea en el ánodo es la fuente de los electrones o carga negativa de la celda. El cátodo de una celda galvánica es su terminal positivo.
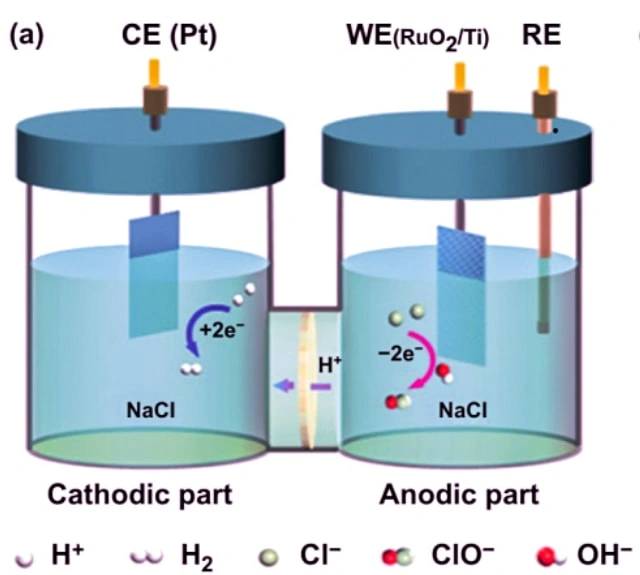
Ejemplo de electrólisis de cloruro de sodio.
Un ejemplo de celda electrolítica es la electrólisis del cloruro de sodio. Cuando el cloruro de sodio se disuelve en agua y se somete a electrólisis, ocurren las siguientes reacciones:
En el cátodo: 2 H2O + 2 e- -> 2 OH- + H2
En el ánodo: 2 Cl- -> Cl2 + 2 e-
Reacción global: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
En esta celda electrolítica, dos electrodos inertes están sumergidos en cloruro de sodio fundido. Cuando una corriente eléctrica pasa por el circuito, el cátodo se enriquece en electrones y desarrolla una carga negativa. Los iones de sodio cargados positivamente son atraídos hacia el cátodo, lo que da como resultado la formación de sodio metálico. Al mismo tiempo, los átomos de cloro son atraídos hacia el ánodo cargado positivamente, lo que conduce a la formación de cloro gaseoso. El resultado general es la producción de sodio metálico, cloro gaseoso e hidróxido de sodio acuoso.
Aplicaciones de las celdas electrolíticas
Las celdas electrolíticas tienen diversas aplicaciones:
- Producción de gas oxígeno y gas hidrógeno a partir de agua.
- Extracción de aluminio a partir de bauxita.
- Galvanoplastia, que implica formar una fina capa protectora de un metal específico sobre la superficie de otro metal.
- Electrorefino de metales no ferrosos.
- Procesos de recuperación electrolítica.
- La producción industrial de cobre de alta pureza, zinc de alta pureza y aluminio de alta pureza casi siempre se realiza a través de celdas electrolíticas.
![Aplicación de celdas electrolíticas (zinc de alta pureza, aluminio de alta pureza, cobre de alta pureza)]()
Aplicación de celdas electrolíticas (zinc de alta pureza, aluminio de alta pureza, cobre de alta pureza)
Las celdas electrolíticas desempeñan un papel crucial en diversas industrias y procesos, permitiendo la producción de importantes productos químicos y materiales.
Aplicaciones de la electrólisis
Uso de la electrólisis en la electrodeposición para refinar o enchapar metales.
La electrólisis se usa ampliamente en el proceso de electrodeposición para refinar o revestir metales. Una aplicación práctica de la electrólisis en este contexto es la electrolimpieza. En la electrolimpieza, el artículo que se va a limpiar, como zinc o aluminio, se convierte en cátodo y se hace pasar una corriente intensa a través de una solución electrolítica. En el cátodo se producen soda cáustica e hidrógeno, que eliminan eficazmente la grasa y las impurezas de la superficie del artículo. Este proceso se puede utilizar para refinar o recubrir metales, proporcionando una apariencia limpia y brillante, protegiendo contra la corrosión y reemplazando materiales desgastados.
Producción de sosa cáustica mediante electrólisis.
Otra aplicación importante de la electrólisis es la producción de productos químicos, incluida la soda cáustica (NaOH) y el cloro gaseoso, a gran escala. En este proceso, se utiliza la electrólisis para descomponer el cloruro de sodio (NaCl) en sus elementos constituyentes, sodio (Na) y cloro (Cl2). La reacción en el cátodo implica la reducción de iones de sodio (Na+) a sodio metálico (Na), mientras que en el ánodo, los iones de cloruro (Cl-) se oxidan para formar cloro gaseoso (Cl2). La reacción celular general es 2NaCl → 2Na + Cl2. Mediante este proceso electrolítico se pueden producir grandes cantidades de soda cáustica y cloro gaseoso para diversas aplicaciones industriales.
Electrólisis en la extracción de metales.
La electrólisis juega un papel crucial en la extracción de metales de sus minerales. Hay dos métodos principales de extracción de metales mediante electrólisis. En el primer método, el mineral se trata con un ácido fuerte para obtener una sal y la solución salina resultante se electroliza para liberar el metal. En el segundo método, el mineral está en estado fundido y se electroliza directamente en un horno.
Un ejemplo de extracción de metales mediante electrólisis es la extracción de zinc. El mineral de zinc se trata con ácido sulfúrico para formar una solución de sulfato de zinc, que luego se electroliza. En el tanque electrolítico se utilizan cátodos de aluminio y ánodos de plomo. El zinc se deposita en los cátodos, mientras que el ácido sulfúrico se regenera en los ánodos. Este proceso electrolítico permite la extracción de zinc de alta pureza.
Asimismo, la electrólisis también se utiliza en la extracción de aluminio a partir de bauxita. La bauxita, un mineral de aluminio, se disuelve en criolita fundida y se somete a electrólisis. Los iones de aluminio se reducen en el cátodo, formando aluminio metálico, mientras que en el ánodo se produce oxígeno gaseoso. Este proceso permite la producción de aluminio de alta pureza.

En general, la electrólisis encuentra aplicaciones prácticas en diversas industrias para la extracción, refinación y enchapado de metales, así como en la producción de productos químicos como la sosa cáustica. Al aprovechar el poder de la electrólisis, las empresas pueden lograr resultados de alta calidad y satisfacer las demandas de sus respectivas industrias.
Conversión de energía química en electricidad
Explicación de la generación de energía en reacciones que involucran sustancias que generan energía.
En las celdas electroquímicas, la energía química se convierte en energía eléctrica mediante un proceso llamado electrólisis. La electrólisis es una reacción redox que ocurre en una celda electroquímica, donde las sustancias químicas se descomponen en los electrodos. Los productos de la electrólisis dependen del tipo de electrodo y electrolito utilizado en la celda. Este proceso es la base para diversas aplicaciones en electroquímica.
El campo de la electroquímica implica la producción de electricidad a partir de la energía liberada durante reacciones químicas espontáneas, así como el uso de energía eléctrica para impulsar cambios químicos no espontáneos. Las reacciones redox, que implican la transferencia de electrones entre especies, son el núcleo de estos procesos. Muchas reacciones químicas y biológicas son reacciones redox y desempeñan un papel crucial en la obtención de energía para fines domésticos, de transporte o industriales.
La energía generada en estas reacciones se utiliza en una amplia gama de aplicaciones, incluida la quema de combustible para la digestión de alimentos en animales, procesos industriales, fotosíntesis, extracción de metales de minerales, fabricación de productos químicos importantes y funcionamiento de baterías y pilas de combustible.
Ejemplo de batería de almacenamiento de plomo-ácido
Un ejemplo de conversión de energía química en electricidad es la batería de almacenamiento de plomo-ácido. Este tipo de batería se utiliza habitualmente como fuente de energía en vehículos. Consta de múltiples celdas electroquímicas conectadas entre sí.

La batería de plomo-ácido funciona como celda electrolítica y galvánica. Al descargarse actúa como una celda galvánica, convirtiendo la energía química en energía eléctrica. Durante el proceso de descarga, el dióxido de plomo, el plomo metálico y el ácido sulfúrico reaccionan para formar sulfato de plomo y agua. La oxidación del plomo a sulfato de plomo ocurre en un electrodo, mientras que la reducción del dióxido de plomo a sulfato de plomo ocurre en el otro electrodo. La carga eléctrica se transporta a través del electrolito mediante la migración de iones de hidrógeno.
Esta separación de los procesos de oxidación y reducción crea una fuerza impulsora, o un voltaje, que hace que la electricidad fluya a través de un circuito externo que conecta los dos electrodos. Se han utilizado muchas otras combinaciones químicas en pilas y baterías, cada una con sus propias reacciones y características específicas.
Celdas de combustible
Las pilas de combustible son otro tipo de celda electroquímica que convierte la energía química del combustible en electricidad. Estas celdas funcionan mediante una reacción electroquímica entre el combustible de hidrógeno y un agente oxidante, normalmente oxígeno. A diferencia de las baterías, que generan energía a partir de sustancias químicas que ya contienen, las pilas de combustible requieren un flujo continuo de oxígeno y un suministro de combustible para generar electricidad.
La NASA ha utilizado comercialmente las pilas de combustible para generar energía para cápsulas espaciales y satélites. Ofrecen ventajas en términos de eficiencia termodinámica, ya que evitan las pérdidas del ciclo de Carnot. Sin embargo, la tecnología actual de pilas de combustible todavía enfrenta desafíos en términos de eficiencia y confiabilidad generales. Una limitación es la imposibilidad de utilizar hidrocarburos directamente, lo que requiere un paso de procesamiento para convertir los combustibles comunes en hidrógeno. Además, la catálisis de la reducción de oxígeno es un proceso complejo.

En resumen, la conversión de energía química en electricidad es un proceso fundamental en electroquímica. Ocurre a través de reacciones redox en celdas electroquímicas, como baterías de almacenamiento de plomo-ácido y pilas de combustible. Estas tecnologías tienen diversas aplicaciones, desde impulsar vehículos hasta generar electricidad para la exploración espacial.
Celdas alternativas para generar electricidad
Comprender las células solares y el papel de los semiconductores y la absorción de luz.
- El silicio amorfo (A-Si) es un material fotovoltaico de película delgada dominante que tiene una capacidad de absorción de luz aproximadamente 40 veces mayor que la del silicio cristalino.
- El telururo de cadmio (CdTe) es otro material de película delgada con alta absortividad de la luz. Puede absorber el 90% del espectro solar con sólo una película de 1 mm de espesor.
- El diseleniuro de indio y cobre (CIGS) es un material semiconductor que ha logrado una alta eficiencia en los fotovoltaicos, y los módulos comerciales alcanzan eficiencias del 14 % o más.

Explicación de las pilas de combustible y su uso de agentes oxidantes y agentes reductores.
- Las pilas de combustible son celdas electroquímicas que hacen reaccionar el combustible de hidrógeno con oxígeno u otro agente oxidante para convertir la energía química en electricidad.
- Se diferencian de las baterías en que requieren una fuente continua de combustible y oxígeno para mantener la reacción química.
- Las pilas de combustible pueden producir electricidad de forma continua siempre que se suministre combustible y oxígeno.
- Se utilizan como energía primaria y de respaldo en diversas aplicaciones, incluidas edificios comerciales, industriales, residenciales y áreas remotas.
- Las pilas de combustible también se utilizan para impulsar vehículos de pila de combustible como carretillas elevadoras, automóviles, autobuses, barcos, motocicletas y submarinos.
- Se espera que el mercado mundial de pilas de combustible aumente un 19,9% para 2030.
Otras celdas para generar electricidad.
- Las células solares generan electricidad mediante la absorción de luz por semiconductores.
- Las pilas de combustible utilizan energía química del combustible para generar electricidad.
- Las pilas recargables se pueden utilizar varias veces recargándolas.
- Las pilas no recargables no se pueden reutilizar y deben desecharse.
- Las baterías de plomo-ácido/plomo son celdas secundarias que se utilizan como fuente de energía en los vehículos.
- Las celdas de película delgada, como las células solares de película delgada, los transistores de película delgada y las baterías de película delgada, ofrecen una eficiencia mejorada, una carga más rápida y una vida útil más larga en comparación con las celdas convencionales.
El campo de las células alternativas para generar electricidad está en constante evolución. Los investigadores continúan mejorando la eficiencia y las propiedades de los materiales de película delgada, mientras que los expertos de la industria trabajan para reducir los costos y aumentar la producción.
Si está interesado en este producto, puede navegar por el sitio web de nuestra empresa: https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple , siempre insistimos en el principio de calidad primero. Durante el proceso de producción, controlamos estrictamente cada paso del proceso, utilizando materiales de alta calidad y tecnología de producción avanzada para garantizar la estabilidad y durabilidad de nuestros productos. para garantizar que su desempeño cumpla con los más altos estándares. Creemos que sólo proporcionando a los clientes una calidad excelente podemos ganarnos su confianza y cooperación a largo plazo.
Productos relacionados
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Célula electroquímica de electrólisis espectral de capa fina
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
Artículos relacionados
- La Variable Oculta: Dominando la Inspección de Celdas Electrolíticas
- Comprender las celdas electrolíticas de cuarzo: Aplicaciones, mecanismos y ventajas
- Comprensión de los electrodos y las celdas electroquímicas
- Aplicaciones de la celda electrolítica tipo H en la extracción de metales
- Superación de desafíos con el funcionamiento de celdas electrolíticas tipo H

















