En esencia, tanto la combustión como la pirólisis son procesos de descomposición térmica que utilizan altas temperaturas para descomponer materiales orgánicos. Representan dos caminos diferentes para transformar la materia con energía, partiendo del mismo principio fundamental de aplicar calor para iniciar un cambio químico.
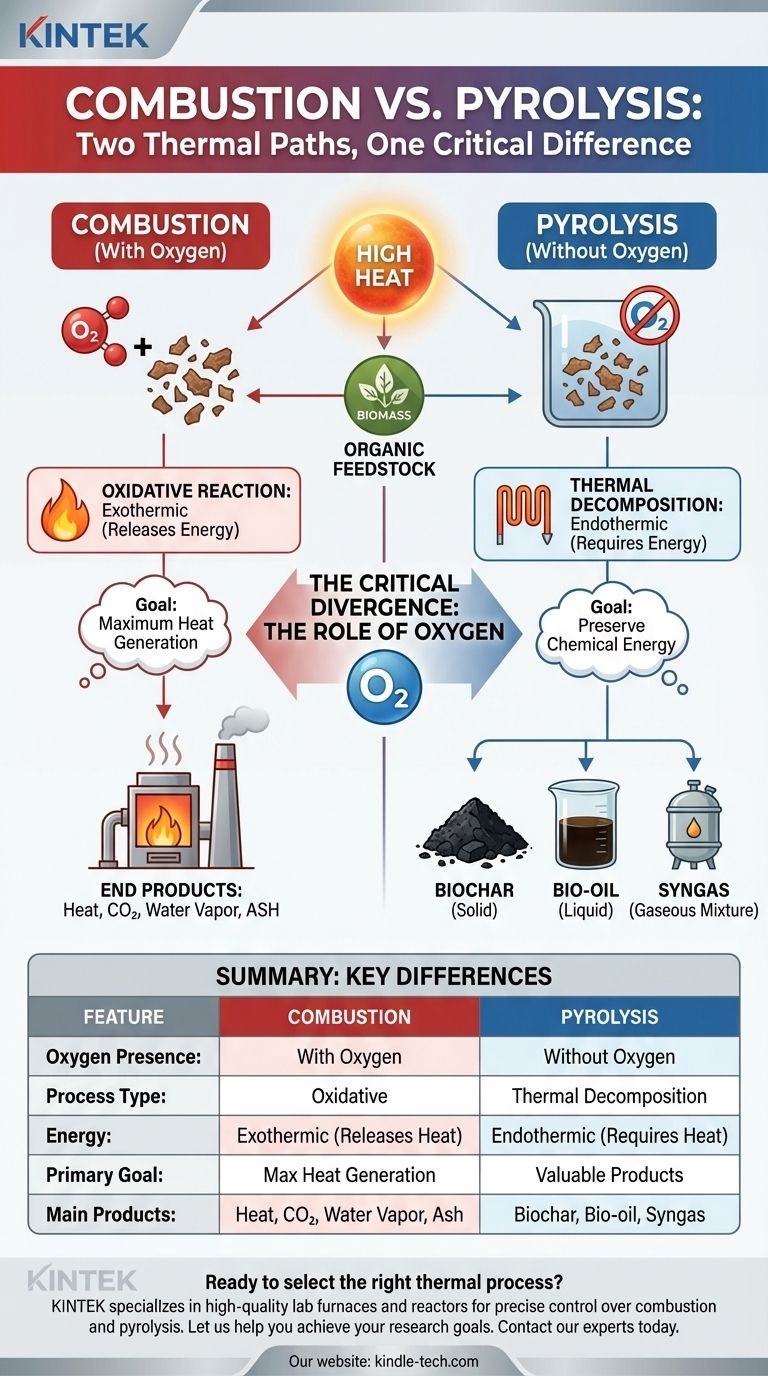
La distinción crucial no es el calor, sino el aire. La combustión es un proceso oxidativo que ocurre con oxígeno, mientras que la pirólisis es un proceso no oxidativo que ocurre sin él, alterando fundamentalmente la reacción y sus productos finales.

La base: lo que ambos procesos comparten
Aunque sus resultados son muy diferentes, la combustión y la pirólisis parten de un punto de inicio compartido. Comprender esta base es clave para entender su relación.
El calor elevado como fuerza impulsora
Ambos procesos dependen de la aplicación de altas temperaturas a una materia prima, típicamente materia orgánica como la biomasa. Esta energía térmica es la que rompe los complejos enlaces químicos dentro del material, iniciando su transformación.
Transformación de la materia prima
En ambos casos, una materia prima sólida o líquida se convierte en diferentes estados de la materia. El material original se descompone irreversiblemente en componentes más simples.
Producción de subproductos gaseosos
Tanto la combustión como la pirólisis liberan gases. Sin embargo, la composición y utilidad de estos gases son un punto principal de divergencia entre ambos métodos.
La divergencia crítica: el papel del oxígeno
La presencia o ausencia de oxígeno es la única variable que determina si el proceso es combustión o pirólisis. Este factor dicta toda la vía química.
Combustión: una reacción oxidativa
La combustión es una reacción exotérmica, lo que significa que libera energía en forma de calor y luz. Se define por la rápida oxidación de una fuente de combustible en presencia de un oxidante, que suele ser oxígeno del aire. Comúnmente lo llamamos "quema".
El objetivo de la combustión es liberar la energía química almacenada del combustible lo más rápido posible.
Pirólisis: una reacción térmica sin oxígeno
La pirólisis es principalmente un proceso endotérmico, lo que significa que requiere un aporte constante de energía para mantener la reacción. Al calentar el material en un ambiente desoxigenado, se evita que se queme.
En lugar de liberarse, la energía química se conserva y concentra en los productos resultantes. Piense en ello como "hornear" o "tostar" el material en lugar de quemarlo.
Comparación de los productos finales
La diferencia más práctica entre los dos procesos es lo que queda una vez completada la reacción.
La combustión produce cenizas y calor
Los productos primarios de la combustión completa son calor, dióxido de carbono (CO2), vapor de agua y un residuo sólido de baja energía conocido como ceniza. El potencial del combustible se ha agotado por completo para generar energía térmica.
La pirólisis produce productos valiosos y densos en energía
La pirólisis descompone el material en tres productos valiosos:
- Biocarbón: Un sólido estable y rico en carbono.
- Bio-aceite: Un líquido que puede refinarse para obtener combustibles.
- Gas de síntesis: Una mezcla de gases combustibles.
Estos productos retienen un alto porcentaje de la energía de la materia prima original, lo que los hace útiles para otras aplicaciones.
Elegir la opción correcta para su objetivo
Comprender la diferencia fundamental le permite seleccionar el proceso adecuado según su objetivo principal.
- Si su objetivo principal es la generación de calor inmediata y máxima: La combustión es el método más directo y simple para convertir la energía química de un combustible en energía térmica.
- Si su objetivo principal es crear productos valiosos y almacenables a partir de una materia prima: La pirólisis es el proceso necesario para preservar la energía química en forma de biocarbón, bio-aceite y gas de síntesis.
En última instancia, la elección entre quemar un material para obtener calor o cocerlo para obtener nuevos productos depende enteramente de la presencia de oxígeno.
Tabla resumen:
| Característica | Combustión | Pirólisis |
|---|---|---|
| Presencia de oxígeno | Con oxígeno | Sin oxígeno |
| Tipo de proceso | Oxidativo | Descomposición térmica |
| Energía | Exotérmico (Libera calor) | Endotérmico (Requiere calor) |
| Objetivo principal | Máxima generación de calor | Producción de productos valiosos |
| Productos principales | Calor, CO₂, Vapor de agua, Ceniza | Biocarbón, Bio-aceite, Gas de síntesis |
¿Listo para seleccionar el proceso térmico adecuado para las necesidades de su laboratorio?
Ya sea que su investigación se centre en la generación de energía o la transformación de materiales, contar con el equipo adecuado es fundamental. KINTEK se especializa en hornos y reactores de laboratorio de alta calidad diseñados para un control preciso sobre los procesos de combustión y pirólisis. Nuestras soluciones garantizan la precisión y repetibilidad que exigen sus experimentos.
Permítanos ayudarle a alcanzar sus objetivos de investigación. Contacte hoy mismo a nuestros expertos para discutir su aplicación específica y encontrar el equipo perfecto para su laboratorio.
Guía Visual
Productos relacionados
- Horno de mufla de 1700℃ para laboratorio
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de alta temperatura para desaglomeración y pre-sinterización de laboratorio
- Horno Tubular de Laboratorio de Alta Temperatura de 1700℃ con Tubo de Alúmina
- Horno de Tubo de Cuarzo para Procesamiento Térmico Rápido (RTP) de Laboratorio
La gente también pregunta
- ¿Cuáles son las ventajas y desventajas de la sinterización? Una guía para la fabricación de alto rendimiento
- ¿Cuál es el metal más común utilizado en la herrería? Comience con acero dulce para el éxito en la forja
- ¿Cuál es la diferencia entre un crisol y un horno? Entendiendo la asociación entre la fuente de calor y el contenedor
- ¿Es un horno de mufla un horno de vacío? Eligiendo la Solución de Alta Temperatura Adecuada para Su Laboratorio
- ¿Cuál es el efecto de la temperatura en la calcinación? Domine el control preciso del calor para las propiedades de los materiales



















