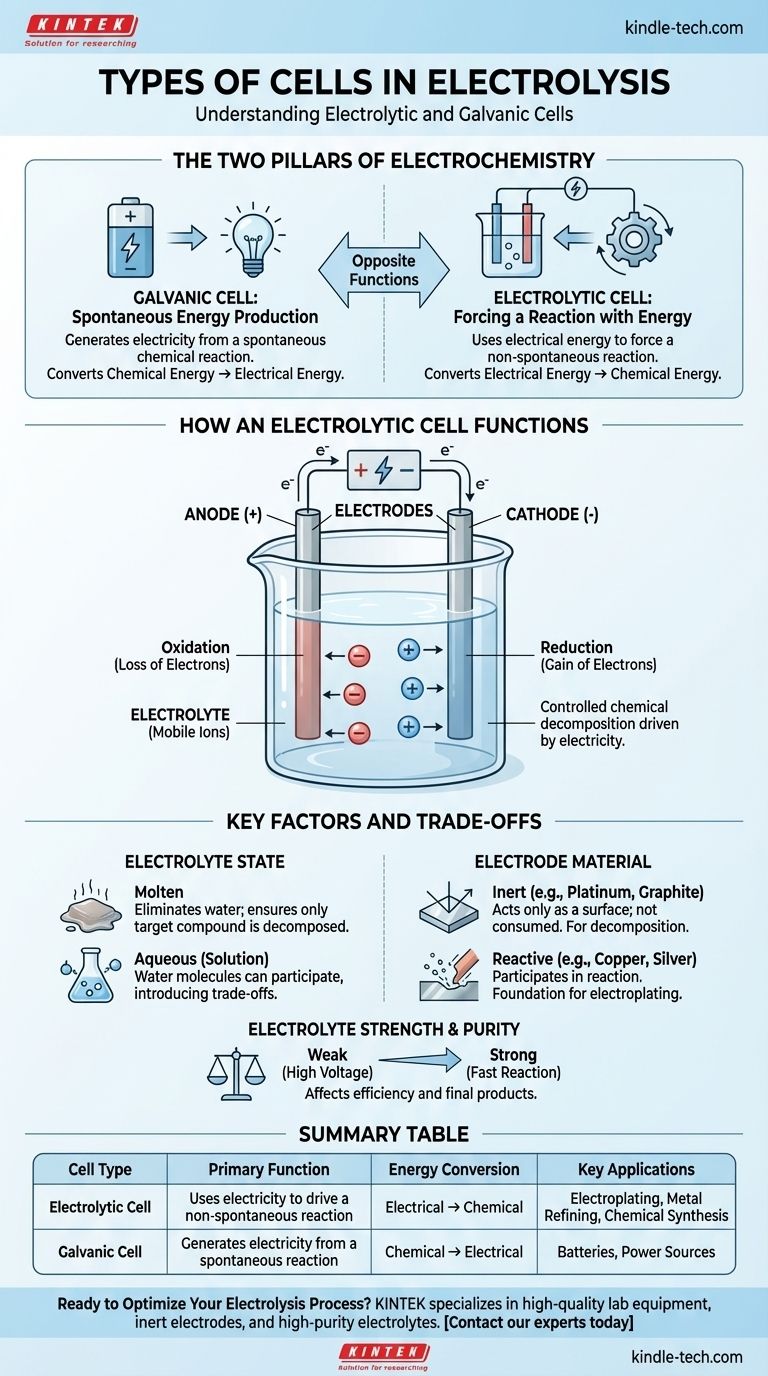
En esencia, la electrólisis ocurre dentro de un tipo específico de celda electroquímica conocida como celda electrolítica. Esta celda es uno de los dos tipos fundamentales de celdas electroquímicas, siendo la otra una celda galvánica. Una celda electrolítica utiliza energía eléctrica para forzar una reacción química no espontánea, mientras que una celda galvánica hace lo contrario, generando electricidad a partir de una reacción química espontánea.
La distinción crítica es el propósito. Una celda galvánica (como una batería) produce electricidad a partir de una reacción química. Una celda electrolítica usa electricidad para impulsar una reacción química que no ocurriría por sí sola.

Los Dos Pilares de la Electroquímica
Para entender la celda utilizada para la electrólisis, primero debes entender su contraparte. Ambos tipos de celdas son fundamentales para la electroquímica, pero cumplen funciones opuestas.
La Celda Galvánica: Producción Espontánea de Energía
Una celda galvánica es lo que comúnmente conocemos como una batería. Aprovecha una reacción química espontánea que naturalmente tiende a ocurrir.
A medida que esta reacción procede, libera energía en forma de corriente eléctrica. Convierte directamente la energía química almacenada en energía eléctrica.
La Celda Electrolítica: Forzando una Reacción con Energía
Una celda electrolítica es el motor de la electrólisis. Está diseñada para hacer que ocurra una reacción química no espontánea suministrando energía externa.
Se aplica una corriente eléctrica de una fuente externa (como una fuente de alimentación) a la celda. Esto fuerza la descomposición de una sustancia, convirtiendo efectivamente la energía eléctrica de nuevo en energía química al crear nuevas sustancias.
Cómo Funciona una Celda Electrolítica
El proceso de electrólisis es una descomposición química controlada impulsada por la electricidad. Esto requiere que algunos componentes clave trabajen en conjunto.
Los Componentes Principales
Una celda electrolítica consta de dos electrodos (un ánodo positivo y un cátodo negativo) sumergidos en un electrolito. Una fuente de alimentación externa está conectada a estos electrodos, creando un circuito.
El Papel del Electrolito
El electrolito es la sustancia que se descompondrá. Típicamente es un compuesto iónico, ya sea en estado fundido o disuelto en una solución (acuosa).
Esta sustancia debe contener iones móviles que sean libres de moverse y transportar una carga. Los electrolitos son generalmente soluciones de ácidos, bases o sales.
La Función de los Electrodos
Los electrodos son los conductores a través de los cuales la electricidad entra y sale del electrolito.
- Ánodo: El electrodo positivo. Atrae iones negativos (aniones), donde ocurre la oxidación (pérdida de electrones).
- Cátodo: El electrodo negativo. Atrae iones positivos (cationes), donde ocurre la reducción (ganancia de electrones).
La fuente de alimentación externa es lo que mantiene esta separación de carga e impulsa todo el proceso.
Entendiendo los Factores Clave y las Compensaciones
El resultado de la electrólisis no es automático. Los productos específicos que creas dependen completamente de los materiales y las condiciones que elijas.
Estado del Electrolito: Fundido vs. Acuoso
El estado del electrolito es una decisión crítica. Si utilizas una solución acuosa (disuelta en agua), las propias moléculas de agua pueden participar en la reacción.
Esto introduce una compensación, ya que la electricidad puede dividir el agua en lugar del compuesto disuelto, dependiendo de qué reacción sea más fácil de impulsar. El uso de un electrolito fundido elimina el agua de la ecuación, asegurando que solo se descomponga el compuesto objetivo.
Material del Electrodo: Inerte vs. Reactivo
Los electrodos pueden ser participantes pasivos o activos en la reacción.
- Electrodos Inertes (ej., Platino, Grafito): Estos actúan solo como una superficie para que ocurra la reacción. No se consumen y se utilizan cuando se desea descomponer el electrolito mismo, como al dividir el agua en hidrógeno y oxígeno.
- Electrodos Reactivos (ej., Cobre, Plata): Estos pueden disolverse o participar en la reacción química. Este es el principio detrás de la galvanoplastia, donde el ánodo se disuelve y sus iones metálicos se depositan sobre el objeto en el cátodo.
Fuerza y Pureza del Electrolito
La eficiencia de la electrólisis también está influenciada por el electrolito. Los electrolitos fuertes, que se disocian completamente en iones, conducen bien la electricidad y permiten una reacción más rápida.
Los electrolitos débiles requieren más energía (un voltaje más alto) para iniciar y mantener la reacción. La presencia de otros agentes oxidantes o reductores en el electrolito también puede alterar los productos finales.
Aplicando Esto a Tu Objetivo
Comprender la función de una celda electrolítica te permite controlar las reacciones químicas para propósitos industriales y científicos específicos.
- Si tu objetivo principal es producir una sustancia pura: Selecciona un electrodo inerte y un electrolito de alta pureza (fundido o acuoso) para asegurar la descomposición del compuesto objetivo, como al producir aluminio a partir de mineral de bauxita.
- Si tu objetivo principal es recubrir o purificar un metal: Utiliza un ánodo reactivo hecho del material de recubrimiento y un electrolito que contenga iones de ese mismo metal. Esta es la base de la galvanoplastia y el electrorefinado.
- Si tu objetivo principal es generar electricidad: Necesitas una celda galvánica, no una electrolítica, ya que su función es liberar energía de una reacción espontánea.
En última instancia, la electrólisis proporciona un método potente para usar energía eléctrica para controlar y impulsar con precisión el cambio químico.
Tabla Resumen:
| Tipo de Celda | Función Principal | Conversión de Energía | Aplicaciones Clave |
|---|---|---|---|
| Celda Electrolítica | Usa electricidad para impulsar una reacción no espontánea | Eléctrica → Química | Galvanoplastia, Refinación de Metales, Síntesis Química |
| Celda Galvánica | Genera electricidad a partir de una reacción espontánea | Química → Eléctrica | Baterías, Fuentes de Energía |
¿Listo para Optimizar tu Proceso de Electrólisis?
Comprender el tipo de celda y los componentes adecuados es crucial para una galvanoplastia, refinación de metales o síntesis química eficientes. KINTEK se especializa en proporcionar equipos de laboratorio y consumibles de alta calidad, incluyendo electrodos inertes y electrolitos de alta pureza, para asegurar que tus procesos electrolíticos sean precisos y efectivos.
Contacta a nuestros expertos hoy para discutir tu aplicación específica y descubrir cómo nuestras soluciones pueden mejorar las capacidades y resultados de tu laboratorio.
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
La gente también pregunta
- ¿Cómo influye el diseño de una celda electrolítica electroquímica en la uniformidad del recubrimiento? Optimice sus catalizadores
- ¿Qué ventajas técnicas ofrecen los convertidores de corriente actuales y la inversión de polaridad? Mejora la longevidad y eficiencia del sistema EC
- ¿Cuáles son las características principales de una célula electrolítica para la corrosión de placa plana? Logre datos de corrosión precisos y repetibles
- ¿Cómo contribuyen las celdas electrolíticas a la separación de ánodos de grafito? Desbloquee el reciclaje de baterías de alta pureza
- ¿Cuál es un ejemplo de método de electrodeposición? Niquelado para ingeniería de superficies de precisión
- ¿Cuál es la importancia de utilizar celdas electrolíticas de alta pureza y resistentes a la corrosión? Garantice recubrimientos PEO de calidad
- ¿Cuáles son las desventajas del método de electrodeposición? Limitaciones clave para el recubrimiento de materiales
- ¿Cuáles son las ventajas de la deposición electroquímica? Desbloquee la precisión, el costo y el recubrimiento conforme



















