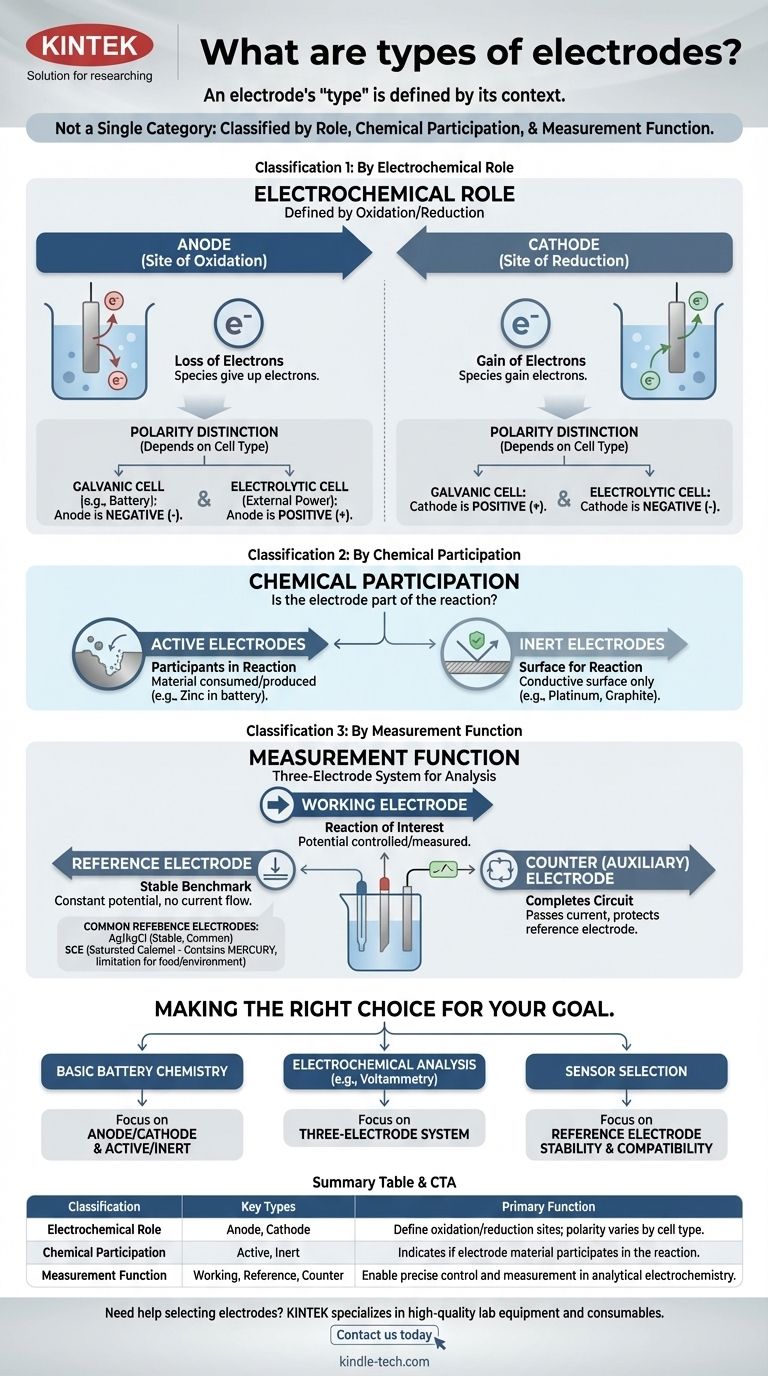
El término "electrodo" no es una categoría única. En cambio, los electrodos se clasifican de varias maneras distintas según su función en una reacción, su participación química y su función dentro de un sistema de medición. Comprender estos diferentes sistemas de clasificación es clave para comprender su propósito en cualquier celda electroquímica.
La idea más crítica es que el "tipo" de un electrodo se define por su contexto. La misma pieza de metal puede ser un ánodo o un cátodo, activo o inerte, dependiendo completamente del sistema electroquímico en el que se coloque.
Clasificación 1: Por función electroquímica
La clasificación más fundamental define un electrodo por su función en las dos mitades de una reacción electroquímica: oxidación y reducción.
El ánodo: El sitio de oxidación
El ánodo es, por definición, el electrodo donde ocurre la oxidación —la pérdida de electrones. Las especies en el ánodo ceden sus electrones al electrodo.
El cátodo: El sitio de reducción
El cátodo es el electrodo donde ocurre la reducción —la ganancia de electrones. El cátodo cede sus electrones a las especies en la solución.
La distinción crítica: Polaridad ánodo/cátodo
Un punto común de confusión es la carga (+ o -) del ánodo y el cátodo. Esta polaridad depende del tipo de celda:
- En una celda galvánica (como una batería), la reacción espontánea genera energía. El ánodo es el terminal negativo y el cátodo es el terminal positivo.
- En una celda electrolítica, una fuente de energía externa impulsa una reacción no espontánea. El ánodo es el terminal positivo y el cátodo es el terminal negativo.
Clasificación 2: Por participación química
Esta clasificación describe si el material del electrodo en sí forma parte de la reacción química.
Electrodos activos: Participantes en la reacción
Un electrodo activo está hecho de un material que se consume o se produce durante la reacción de la celda. Por ejemplo, en una batería de zinc-cobre, el ánodo de zinc se disuelve, participando activamente en la semirreacción de oxidación.
Electrodos inertes: Una superficie para la reacción
Un electrodo inerte no participa en la reacción química. Sirve únicamente como una superficie conductora donde puede tener lugar la oxidación o la reducción. El platino y el carbono (grafito) son electrodos inertes comunes utilizados para facilitar reacciones que involucran gases o iones disueltos.
Clasificación 3: Por función de medición
En electroquímica analítica, a menudo se utiliza un sistema de tres electrodos para mediciones precisas. Esto da lugar a una clasificación funcional.
El electrodo de trabajo
Este es el electrodo donde ocurre la reacción de interés. Su potencial es la variable principal que se controla o se mide.
El electrodo de referencia: El punto de referencia estable
Un electrodo de referencia proporciona un potencial estable y constante contra el cual se mide el potencial del electrodo de trabajo. Su propio potencial no cambia independientemente de la corriente que fluye o de la composición de la solución a granel.
El contraelectrodo (o auxiliar)
El único propósito de este electrodo es completar el circuito eléctrico. Pasa toda la corriente necesaria para el electrodo de trabajo, asegurando que una corriente insignificante fluya a través del sensible electrodo de referencia, protegiendo así su estabilidad.
Comprender las compensaciones: Electrodos de referencia comunes
La elección del electrodo de referencia es fundamental para realizar mediciones precisas y depende del entorno químico.
Ag/AgCl: El caballo de batalla común
El electrodo de plata/cloruro de plata (Ag/AgCl) es el electrodo de referencia más común. Es estable, económico y generalmente confiable, lo que lo convierte en una opción predeterminada para muchas soluciones acuosas.
Electrodo de calomelanos saturado (ECS): La alternativa clásica
El electrodo de calomelanos saturado (ECS) es un estándar más antiguo y altamente estable. A menudo se utiliza en situaciones en las que la solución de la muestra es incompatible con iones de plata o cloruro, lo que podría interferir con el electrodo de Ag/AgCl.
El problema del mercurio: Una limitación clave
El principal inconveniente del ECS es que contiene mercurio. Esto lo hace inadecuado para aplicaciones que involucran alimentos, bebidas o pruebas ambientales donde la contaminación por mercurio es una preocupación significativa.
Tomar la decisión correcta para su objetivo
Su aplicación determina qué clasificación es la más importante.
- Si su enfoque principal es comprender la química básica de las baterías: Domine los conceptos de ánodo/cátodo y electrodos activos/inertes.
- Si su enfoque principal es realizar análisis electroquímicos (como la voltamperometría): El sistema de tres electrodos (trabajo, referencia, contraelectrodo) es el marco esencial.
- Si su enfoque principal es seleccionar un sensor para un entorno específico: Su principal preocupación será la compatibilidad química y la estabilidad de su electrodo de referencia, como elegir entre Ag/AgCl y una alternativa.
Comprender estas clasificaciones superpuestas le permite controlar e interpretar el comportamiento de cualquier sistema electroquímico.

Tabla resumen:
| Clasificación | Tipos clave | Función principal |
|---|---|---|
| Función electroquímica | Ánodo, Cátodo | Define los sitios de oxidación/reducción; la polaridad varía según el tipo de celda (galvánica/electrolítica) |
| Participación química | Activo, Inerte | Indica si el material del electrodo participa en la reacción o actúa solo como superficie |
| Función de medición | Trabajo, Referencia, Contraelectrodo | Permite un control y una medición precisos en electroquímica analítica |
¿Necesita ayuda para seleccionar los electrodos adecuados para las aplicaciones electroquímicas de su laboratorio? En KINTEK, nos especializamos en proporcionar equipos y consumibles de laboratorio de alta calidad adaptados a sus necesidades de investigación. Ya sea que esté trabajando en el desarrollo de baterías, el diseño de sensores o mediciones analíticas, nuestra experiencia garantiza que obtenga los electrodos óptimos para la precisión y el rendimiento. Contáctenos hoy para discutir sus requisitos y mejorar sus flujos de trabajo electroquímicos.
Guía Visual
Productos relacionados
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo de Disco de Oro
- Electrodo de Referencia de Sulfato de Cobre para Uso en Laboratorio
- Electrodo Auxiliar de Platino para Uso en Laboratorio
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
La gente también pregunta
- ¿Cuál es la aplicación de RRDE? Desbloquee conocimientos cuantitativos sobre catalizadores y reacciones
- ¿Qué es el método de electrodo de disco de anillo giratorio? Desbloquee el análisis de reacciones en tiempo real
- ¿Cuál es el papel común de un electrodo de disco de platino? Una guía para su uso principal como electrodo de trabajo
- ¿Cómo se debe limpiar un electrodo de hilo/varilla de platino antes de usarlo? Una guía para datos electroquímicos fiables
- ¿Cuál es la diferencia entre RDE y RRDE? Desbloquee el análisis avanzado de reacciones electroquímicas



















