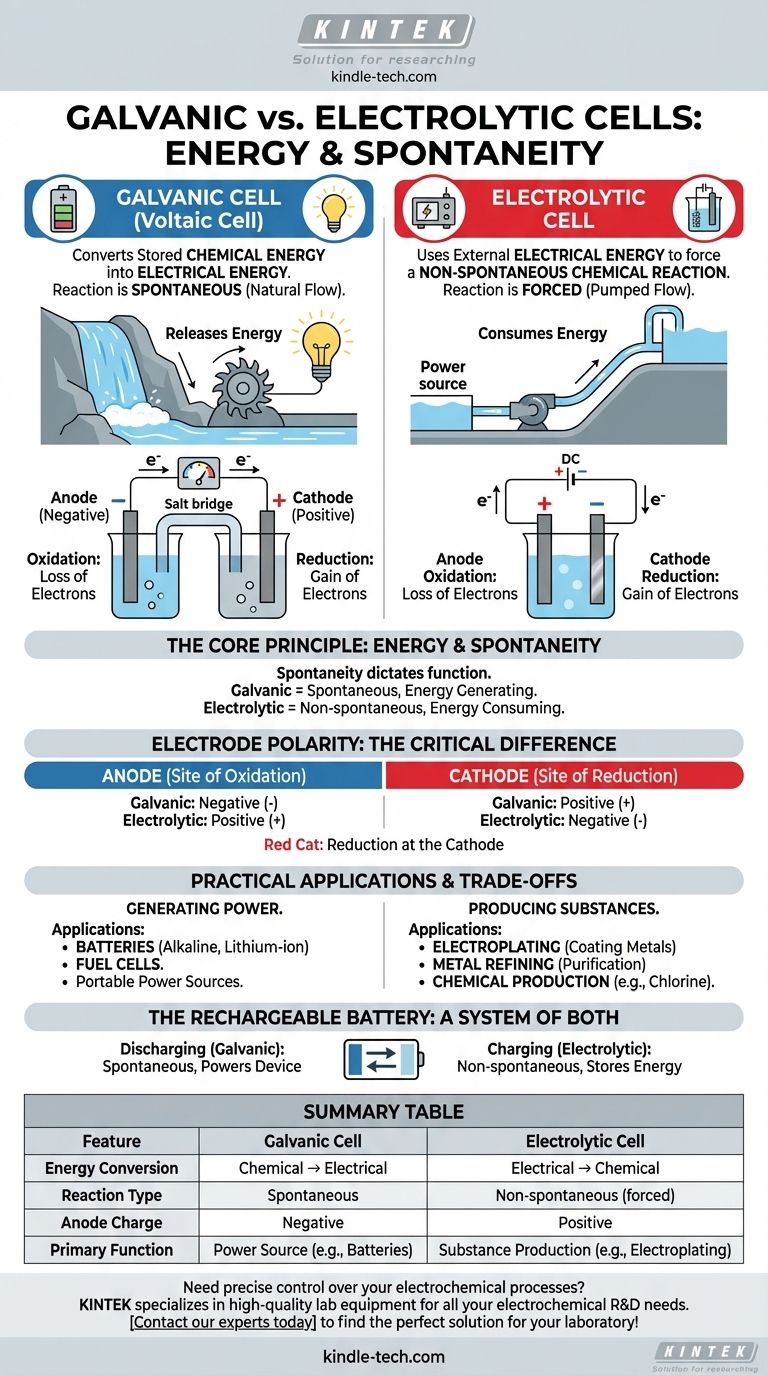
En esencia, la diferencia entre una celda galvánica y una celda electrolítica es la dirección de la conversión de energía. Una celda galvánica (o voltaica) convierte la energía química almacenada en energía eléctrica a través de una reacción espontánea, como una batería que alimenta un dispositivo. Por el contrario, una celda electrolítica utiliza energía eléctrica externa para forzar que ocurra una reacción química no espontánea, como en el recubrimiento de metales.
La distinción fundamental radica en la espontaneidad. Las celdas galvánicas aprovechan una reacción química que ocurre por sí sola, liberando energía en forma de electricidad. Las celdas electrolíticas utilizan electricidad para forzar una reacción química que de otro modo no ocurriría.

El Principio Fundamental: Energía y Espontaneidad
El comportamiento de cualquier celda electroquímica se rige por si su reacción redox interna es espontánea o no espontánea. Este único principio dicta su función y estructura.
Celdas Galvánicas: Generando Energía
En una celda galvánica, la reacción química es espontánea. Esto significa que los reactivos tienen mayor energía potencial que los productos, y la reacción procede naturalmente, liberando energía.
Esta energía liberada impulsa los electrones a través de un circuito externo, creando una corriente eléctrica. Piense en ello como una cascada: el agua fluye naturalmente cuesta abajo, y podemos colocar una turbina en su camino para generar electricidad.
Celdas Electrolíticas: Consumiendo Energía
En una celda electrolítica, la reacción química deseada es no espontánea. Los productos se encuentran en un estado de energía más alto que los reactivos, por lo que la reacción no ocurrirá por sí sola.
Para que ocurra, debemos suministrar energía de una fuente de alimentación externa (como una batería o una fuente de energía). Este voltaje externo fuerza a los electrones a moverse en contra de su dirección natural, impulsando la reacción. Esto es como usar una bomba para mover agua cuesta arriba.
Cómo Este Principio Define los Componentes de la Celda
Si bien las definiciones fundamentales del ánodo y el cátodo permanecen iguales, su carga (polaridad) se invierte entre los dos tipos de celdas. Este es un punto común de confusión, pero es una consecuencia directa de la espontaneidad.
El Ánodo: Siempre el Sitio de la Oxidación
En ambos tipos de celdas, el ánodo se define como el electrodo donde tiene lugar la oxidación (la pérdida de electrones).
El Cátodo: Siempre el Sitio de la Reducción
De manera similar, en ambos tipos de celdas, el cátodo es el electrodo donde ocurre la reducción (la ganancia de electrones). Una mnemotécnica simple es "Gato Rojo" (Ganancia en el Cátodo, Reducción).
La Diferencia Crítica: Polaridad del Electrodo
En una celda galvánica, la oxidación espontánea en el ánodo libera un flujo de electrones. Esta acumulación de carga negativa hace que el ánodo sea negativo y el cátodo, que atrae los electrones, sea positivo.
En una celda electrolítica, se utiliza una fuente de alimentación externa. Su terminal positivo se conecta al ánodo, donde extrae forzosamente los electrones de las especies químicas, provocando la oxidación. Por lo tanto, el ánodo es positivo y el cátodo es negativo.
Aplicaciones Prácticas y Compromisos
La diferencia entre generar y consumir energía conduce a aplicaciones en el mundo real completamente diferentes para estos dos tipos de celdas.
Celdas Galvánicas en la Práctica: Energía Portátil
Las celdas galvánicas están diseñadas para ser fuentes de energía. Su aplicación principal es en baterías, desde baterías alcalinas de un solo uso hasta celdas de iones de litio recargables en su teléfono y automóvil.
Las celdas de combustible son otro tipo de celda galvánica, que generan electricidad continuamente siempre que se suministre combustible (como hidrógeno).
Celdas Electrolíticas en la Práctica: Fabricación y Refinación
Las celdas electrolíticas son herramientas industriales utilizadas para producir materiales. Las aplicaciones clave incluyen la electrodeposición (recubrir un objeto con una fina capa de metal) y la purificación de metales como el cobre y el aluminio.
También son esenciales para producir productos químicos industriales clave, como el gas cloro y el hidróxido de sodio a partir de agua salada (salmuera).
La Batería Recargable: Un Sistema de Ambos
Una batería recargable es la ilustración perfecta de ambos principios. Cuando alimenta su dispositivo, actúa como una celda galvánica, ejecutando una reacción espontánea. Cuando la conecta para cargarla, una fuente de energía externa invierte el proceso, convirtiéndola en una celda electrolítica para impulsar una reacción no espontánea y restaurar los reactivos iniciales.
Tomando la Decisión Correcta para Su Objetivo
Su comprensión de qué celda considerar depende completamente de si necesita producir energía o producir una sustancia.
- Si su enfoque principal es generar energía a partir de una reacción química: Está trabajando con una celda galvánica, donde un proceso espontáneo crea una corriente eléctrica.
- Si su enfoque principal es crear una sustancia usando electricidad: Está utilizando una celda electrolítica, donde un voltaje externo impulsa un cambio químico no espontáneo.
- Si su enfoque principal es almacenar y reutilizar energía eléctrica: Está tratando con un sistema recargable que alterna entre ser una celda electrolítica (cargando) y una celda galvánica (descargando).
En última instancia, estos dos tipos de celdas son dos caras de la misma moneda electroquímica, definidas por la dirección del flujo de energía.
Tabla Resumen:
| Característica | Celda Galvánica | Celda Electrolítica |
|---|---|---|
| Conversión de Energía | Química → Eléctrica | Eléctrica → Química |
| Tipo de Reacción | Espontánea | No espontánea (forzada) |
| Carga del Ánodo | Negativa | Positiva |
| Función Principal | Fuente de Energía (ej., Baterías) | Producción de Sustancias (ej., Electrodeposición) |
¿Necesita un control preciso sobre sus procesos electroquímicos? El equipo de laboratorio adecuado es crucial para obtener resultados precisos, ya sea que esté desarrollando nuevos materiales para baterías o refinando técnicas de recubrimiento de metales. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad para todas sus necesidades de investigación y desarrollo electroquímico. ¡Contacte a nuestros expertos hoy mismo para encontrar la solución perfecta para su laboratorio!
Guía Visual
Productos relacionados
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Célula electrolítica electroquímica de cinco puertos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
La gente también pregunta
- ¿Qué papel juega una celda electrolítica encamisada por agua en las mediciones de corrosión electroquímica a temperatura variable?
- ¿Para qué tipo de sistema de electrodos está diseñada la celda electrolítica de evaluación de recubrimientos? Desbloquee el análisis preciso de recubrimientos
- ¿Cuáles son las ventajas de una celda electroquímica plana para la corrosión? Logre un análisis preciso de picaduras y grietas
- ¿Cómo funciona una celda electrolítica de tres electrodos? Pruebas de precisión para acero 8620 en entornos corrosivos
- ¿Cómo se utiliza una celda electrolítica de alta precisión para evaluar la resistencia a la corrosión de los metales? Valide los resultados de DCT con precisión







